2013年10月我市因台风菲特遭受到重大损失,市疾控中心紧急采购消毒药品,以满足灾后需要.复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H
2O
2是一种无色粘稠液体,请回答下列问题:
(1)下列方程中H
2O
2所体现的性质与其可以作为消毒剂完全一致的是
.
A.BaO
2+2HCl
H
2O
2+BaCl
2 B.Ag
2O+H
2O
2═2Ag+O
2+H
2O
C.2H
2O
22H
2O+O
2↑ D. H
2O
2+NaCrO
2+NaOH═Na
2CrO
4+H
2O
(2)火箭发射常以液态肼(N
2H
4)为燃料,液态H
2O
2为助燃剂.已知:
N
2H
4(l)+O
2(g)=N
2(g)+2H
2O(g)△H=-534kJ?mol
-1H
2O
2(l)=H
2O(l)+
O
2(g)△H=-98.64kJ?mol
-1H
2O(l)=H
2O(g)△H=+44kJ?mol
-l则反应N
2H
4(l)+2H
2O
2(l)=N
2(g)+4H
2O(g)的△H=
,该反应的△S=
0(填“>”或“<”).
(3)H
2O
2是一种不稳定易分解的物质.
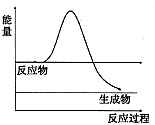
①如图是H
2O
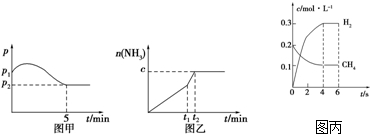
2在没有催化剂时反应进程与能量变化图,请在图上画出使用催化剂加快分解速率时能量与进程图
②实验证实,往Na
2CO
3溶液中加入H
2O
2也会有气泡产生.已知常温时H
2CO
3的电离常数分别为Ka
l=4.3×l0
-7,Ka
2=5.0×l0
-11.Na
2CO
3溶液中CO
32-第一步水解常数表达式K
hl=
,常温时K
hl的值为
.若在Na
2CO
3溶液中同时加入少量Na
2CO
3固体与适当升高溶液温度,则K
hl的值
(填变大、变小、不变或不确定).
(4)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示.
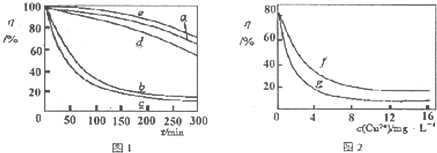
注:以上实验均在温度为20℃、w(H
2O
2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg?L
-l的条件下进行.图1中曲线a:H
2O
2;b:H
2O
2+Cu
2+;c:H
2O
2+Fe
2+;d:H
2O
2+Zn
2+;e:H
2O
2+Mn
2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关).
由上述信息可知,下列叙述错误的是
(填序号).
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小.



 ,故答案为:
,故答案为: ;
;

 发散思维新课堂系列答案
发散思维新课堂系列答案 “钠-硫”原电池具有输出功率较高.循环寿命长等优点,其工作原理可表示为:2Na+xS
“钠-硫”原电池具有输出功率较高.循环寿命长等优点,其工作原理可表示为:2Na+xS 转化为
转化为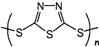 的过程
的过程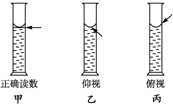 实验室用碳酸钠晶体配制1.00mol?L-1的Na2CO3溶液100mL,完成下列问题:
实验室用碳酸钠晶体配制1.00mol?L-1的Na2CO3溶液100mL,完成下列问题:
 X、Y、Z是三种常见的物质,它们之间存在着如图的转化关系:
X、Y、Z是三种常见的物质,它们之间存在着如图的转化关系: