
| A. | 烧杯中溶液转移到容量瓶中时,未洗涤烧杯 | |
| B. | 移液时,有少量液体溅出 | |
| C. | 定容时,俯视刻度线 | |
| D. | 定容摇匀后发现液面下降,继续加水至刻度线 |
分析 分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使物质的量n偏大或者使溶液体积V偏小的操作都会导致溶液浓度偏高,反之溶液浓度偏低,据此解答.
解答 解:A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯,导致溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.移液时,有少量液体溅出,导致溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B不选;
C.定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故C选;
D.定容摇匀后发现液面下降,继续加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:C.
点评 本题考查了一定物质的量浓度溶液的配制误差分析,明确配制原理依据C=$\frac{n}{V}$进行误差分析,注意操作对n和V的影响,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中含有NA个HCl分子 | |
| B. | 所得溶液的物质的量浓度:c=1mol•L-1 | |
| C. | 36.5gHCl气体占有的体积为22.4L | |
| D. | 所得溶液的质量分数:ω=$\frac{36.5c}{1000ρ}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2既具有氧化性又具有还原性 | |
| B. | 1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol | |
| C. | NaNO2和胃酸作用的离子方程式为:2NO${\;}_{2}^{-}$+2H+=NO↑+NO2↑+H2O | |
| D. | 食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、S、Br2 | B. | CH4、SiH4、GeH4 | C. | Li、Na、K | D. | H2O、H2S、H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下1mol任何物质所占体积都是22.4升 | |
| B. | 当压强大于101KPa时1mol任何气体的体积都小于22.4升 | |
| C. | 在相同条件下,两种物质的量相同的气体必然具有相同的原子数 | |
| D. | 气体摩尔体积的数值受温度和压强的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
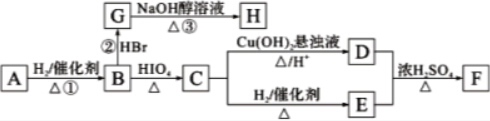
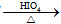 RCHO+R′CHO
RCHO+R′CHO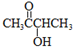 .
. CH3COO-+NH4++2Ag↓+3NH3+H2O.
CH3COO-+NH4++2Ag↓+3NH3+H2O. .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
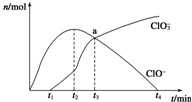 工业上把Cl2通入NaOH溶液中制得漂白液(主要成分NaClO).一化学小组模拟实验得到ClO-、ClO${\;}_{3}^{-}$等离子其物质的量(mol)与反应时间t(min)的关系曲线:
工业上把Cl2通入NaOH溶液中制得漂白液(主要成分NaClO).一化学小组模拟实验得到ClO-、ClO${\;}_{3}^{-}$等离子其物质的量(mol)与反应时间t(min)的关系曲线:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com