
| A. | 16、30、58、72 | B. | 16、28、40、52 | C. | 16、32、48、54 | D. | 16、30、42、56 |
科目:高中化学 来源: 题型:解答题
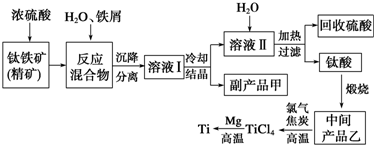
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 属于正四面体的空间结构 | B. | 分子中的碳原子是饱和的 | ||
| C. | 没有同分异构体 | D. | 是甲烷的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g);△H=-Q kJ/mol.Q的值小于297.23 kJ/mol | |
| B. | S(g)+O2(g)=SO2(g);△H=-Q kJ/mol.Q的值大于297.23 kJ/mol | |
| C. | 1mol SO2的键能总和等于1molS和1molO2的键能和 | |
| D. | 1mol SO2的键能总和小于1molS和1molO2的键能和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com