下列说法正确的是( )
A.相同物质的量的O2和O3,体积相同
B.离子化合物一定含有离子键,可能含有共价键
C.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S
D.常温下,等体积、pH均为3的醋酸和硫酸分别与完全相同的镁条反应,硫酸产生氢气速率快
【答案】
分析:A.温度和压强不同,气体摩尔体积不同,根据V=
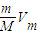
判断气体体积;
B.含有离子键的化合物是离子化合物,可能含有共价键;
C.根据其最高价含氧酸的酸性强弱可以判断非金属的非金属性强弱;
D.产生氢气的速率与氢离子浓度成正比.
解答:解:A.因为温度和压强未知,所以气体摩尔体积未知,无法确定其根据大小,故A错误;
B.离子化合物中一定含有离子键,可能含有共价键,如KOH,如B正确;
C.不能根据氢化物的酸性强弱判断非金属单质的氧化性强弱,但可以根据氢化物的稳定性判断其非金属元素的氧化性强弱,故C错误;
D.产生氢气的速率与氢离子浓度成正比,刚开始时,氢离子浓度相等,反应速率相等,随着反应的进行,稀硫酸中氢离子浓度减少比醋酸中快,所以醋酸与镁反应速率大于稀硫酸,故D错误;
故选B.
点评:本题考查非金属性强弱的判断、化合物和化学键的关系、影响反应速率的因素等,易错选项是C,明确非金属性强弱的判断方法,为常考查点.

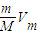 判断气体体积;
判断气体体积;

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,