
25℃时,水的电离平衡:H2O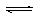 H++OH— △H>0,下列叙述正确的是( )
H++OH— △H>0,下列叙述正确的是( )
| A.向水中加入稀氨水,平衡逆向移动,c(OH—)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量NaCl溶液,平衡不移动,c(H+)降低 |
| D.将水加热,Kw增大,c(H+)不变, pH不变 |
科目:高中化学 来源:南京市2007届高三质量检测、化学 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出N2的电子式_________________________________。
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol.L-1NH4NO3溶液中水的电离程度___________(填“大于”“等于”或“小于”)0.1 mol·L-1NaOH溶液中水的电离程度。若将0.1 mOl·L-1NaOH和0.2 m01.L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为______________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+====![]() + H2O
+ H2O
N2H4+ H2O![]()
![]() + OH-
+ OH-
![]() +H2O
+H2O![]()
![]() +OH-
+OH-
![]() +H2O
+H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是__________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO====NaCl+______N2H4+______ ______
(6)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的热化学方程式)___________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省高三12月月考化学试卷(解析版) 题型:填空题
硫酸工厂尾气处理时用NaOH溶液吸收SO2生成NaHSO3,再用NaIO3按下列反应(配平)来制取单质I2。NaIO3来源于自然界的矿物。
① NaIO3 + NaHSO3— NaI + Na2SO4 + H2SO4 ② IO3-+I-+H+—I2+H2O
(1)配平上述反应
(2)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。请计算开始产生单质I2及产生单质I2最大值时所滴入的NaIO3的物质的量各是多少?
(3)25℃时,H2SO3  HSO3-
+ H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh=
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-
+ H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh=
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中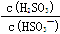 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,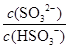 的值
;加入少量水,水的电离程度将 。
的值
;加入少量水,水的电离程度将 。
查看答案和解析>>
科目:高中化学 来源: 题型:
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)写出N2的电子式______________。
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为______________________________。
(3)25℃时,0.1 mol?L-1 NH4NO3溶液中水的电离程度_______(填“大于”、“等于“或“小于”)0.1 mol?L-l NaOH溶液中水的电离程度。若将0.1mol?L-1NaOH和0.2mol?L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为_________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+==N2H![]() +H2O N2H4+H2O
+H2O N2H4+H2O![]() N2H
N2H![]() +OH-
+OH-
N2H![]() +H2O
+H2O![]() N2H
N2H![]() +OH- N2H
+OH- N2H![]() + H2O
+ H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO==_________NaCl+_______N2H4+_____ _____
(6)发射火箭时胼(N2+H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的转化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。请回答相关问题:
(1)目前常用乙基蒽醌法制备过氧化氢,主要过程如下图,此过程的总方程式为 。

(2)实验测得常温下质量分数为0.51%H2O2水溶液(密度为1g/mL)的pH为5
i.写出H2O2溶于水的电离方程式 .
ii.测定H2O2水溶液pH的方法为(填编号)
A.用酸碱指示剂测定 B.用广泛pH试纸测定
C.用精密pH试纸测定 D.用pH计测定
(3)某实验小组拟研究浓度、催化剂、溶液酸碱性对H2O2分解反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 0.1gMnO2粉末 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
i.实验①和②的目的是_______。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2较稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_________。
ii.实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析该图能够得出的实验结论是____________。
(4)实验室常用酸性高锰酸钾标准溶液测定双氧水的浓度,反应原理为:
MnO4-+H2O2+H+ —Mn2++H2O+ O2↑
i.请配平以上离子方程式
ii.用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗0.1000 mol·L-1的KMnO4标准溶液体积如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为 mol·L-1。
iii.若滴定前尖嘴中有气泡滴定后消失,则测定结果 (“偏高”或“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com