
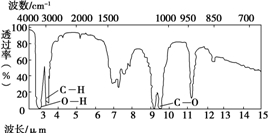
 有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:
有机物A由碳、氢、氧三种元素组成.现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过足量的浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.回答下列问题:| m |
| M |
| V |
| Vm |
| 3.6g |
| 18g/mol |
| 4.4g |
| 44g/mol |
| 4.48L |
| 22.4L/mol |
| 1.4g |
| 28g/mol |
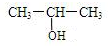 ,
,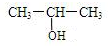 .
.


科目:高中化学 来源: 题型:
| A、充分振荡后静置,溶液颜色变为紫色 |
| B、上述实验中不能用盐酸代替硫酸 |
| C、在酸性条件下,PbO2的氧化性比MnO4-的氧化性强 |
| D、若上述实验完全反应,消耗PbO2的物质的量为0.01mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 待测橙汁的体积/mL | 滴定完成时,消耗I2标准溶液的体积/mL |
| 1 | 25.00 | 14.93 |
| 2 | 25.00 | 15.10 |
| 3 | 25.00 | 14.97 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为: ,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)n].该化合物为高强度纤维材料,其结构简式为
,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)n].该化合物为高强度纤维材料,其结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com