
【题目】(1)①25 ℃时,NaHCO3溶液呈碱性,原因是_________水解引起的(填“Na+”或 “HCO3-”);
②常温下,0.0100 mol/L盐酸的pH=__________
③用0.0100 mol/L盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时, 溶液的颜色由红色变为__________(填“蓝色”或“无色”),且半分钟内保持不变。
(2)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0平衡常数表达式为K=c(CO2)/c(CO)。
Fe(s)+CO2(g) ΔH>0平衡常数表达式为K=c(CO2)/c(CO)。
①反应达到平衡后,向容器中通入CO,化学平衡向____方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”);
③查阅资料得知1 100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________平衡状态(填“达到”或“未达到”)。
【答案】HCO3- 2 无色 正反应 增大 未达到
【解析】
(1)①碳酸氢钠是强碱弱酸盐,能发生水解生成碳酸和氢氧化钠而使溶液呈碱性;②常温下,0.0100mol/L盐酸溶液中c(H+)=0.01mol/L,结合pH=-lgc(H+)计算;③根据酚酞的变色范围8-10分析判断;
(2)①增大反应物浓度平衡正向移动;②升高温度平衡向吸热反应方向移动;③根据浓度商和平衡常数的相对大小判断是否为平衡状态。
(1)①碳酸氢钠是强碱弱酸盐,HCO3-能发生水解,HCO3-+H2O![]() H2CO3+OH-,水解生成了氢氧根离子,使溶液显碱性,故答案为:HCO3-;
H2CO3+OH-,水解生成了氢氧根离子,使溶液显碱性,故答案为:HCO3-;
②常温下,0.0100mol/L盐酸溶液中c(H+)=0.01mol/L,溶液的pH=2,故答案为:2;
③用0.0100mol/L盐酸溶液滴定未知浓度的氢氧化钠溶液,酚酞作指示剂,滴定终点时,溶液的颜色由红色变为无色,且半分钟内保持不变,故答案为:无色;
(2)①反应达到平衡后,向容器中通入CO,CO浓度增大,化学平衡向正反应方向移动,故答案为:正反应;
②该反应为吸热反应,升高温度,平衡正向移动,平衡常数K增大,故答案为:增大;
③查阅资料得知1100℃时K=0.263.某时刻测得容器中c(CO2)=0.025mol/L,c(CO)=0.10mol/L,则Qc=![]() =0.25<K=0.263,反应未达到平衡状态,反应正向进行,故答案为:未达到。
=0.25<K=0.263,反应未达到平衡状态,反应正向进行,故答案为:未达到。


科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为: WO3(s) + 3H2(g)![]() W (s) + 3H2O (g),请回答下列问题:
W (s) + 3H2O (g),请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率______;该反应的平衡常数表达式K=_____。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为______(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2(g)![]() WI4(g)。下列说法正确的有__________。
WI4(g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s,灰)![]() Sn(s,白) △H3=+2.1kJmol-1
Sn(s,白) △H3=+2.1kJmol-1
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)和莫尔盐[(NH4)2SO4·FeSO4·6H2O]是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5。
①氢叠氮酸在水溶液中的电离方程式为_______
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,此时,溶液呈酸性,则混合溶液中各离子和HN3分子浓度由大到小的顺序为_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体[(NH4)2Fe(SO4)2·6H2O],为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
①配制莫尔盐溶液,所使用的玻璃仪器除了烧杯和玻璃棒外还有_______
②滴定终点的现象是_______,通过实验数据,计算该产品的纯度为_______(用含字母a、c的式子表示)。
③上表第一次实验中记录数据明显大于后两次,其原因可能是_______。
A 第一次滴定时,锥形瓶用待装液润洗
B 该酸性高锰酸钾标准液保存时间过长,部分变质
C 滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是
A.CH4+C12![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2= CH2+ C12![]()
![]()
C.![]() +Br2
+Br2![]()
![]() +HBr
+HBr
D.CH4+2O2![]() CO2+2H2O
CO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究汽车尾气的产生、转化对环境保护有重要意义。汽车尾气管中的三元催化剂能同时实现CO、CxHy、NOn三种成分的净化。
(1)已知热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
则反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=____kJ·mol-1。
(2)研究表明,温度对CO、CxHy、NOn的产生和排放有较大影响。
①汽车发动机内的温度越高,生成的NO越多,原因是____。
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。汽车刚冷启动时排放CO、CxHy、NOn浓度较高的原因是____。
(3)催化剂表面CO、CxHy、NOn的转化如图1所示,化合物W可借助图2 (傅里叶红外光谱图)确定。
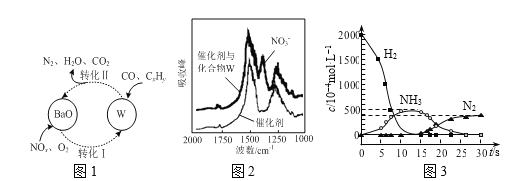
①在图1所示转化中,W的化学式为____。若转化Ⅱ中消耗CO的物质的量为1mol,生成N2的物质的量为1mol,则被CxHy还原的W的物质的量为____。
②用H2代替CO、CxHy与W反应,该过程相关物质浓度随时间的变化关系如图3所示。该过程分为两步,第一步反应消耗的H2与W的物质的量之比是____。
(4)尾气净化过程中,有时会产生N2O。用同位素示踪法研究发现N2O的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的N2O几乎都是15NNO。写出该反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 向0.1mol/L碳酸钠溶液中滴入酚酞,溶液变红,加热,红色加深。 | 碳酸钠属于弱碱 |
B | 测定醋酸溶液pH,用玻璃棒蘸取溶液,点在pH试纸上,试纸显红色。 | 醋酸溶液显酸性 |
C | 将铜片和锌片用导线相连,插入CuSO4溶液中,锌片质量减小,铜片质量增加。 | 锌被还原 |
D | 向氯化银的浊液中滴入KI溶液,浊液中的固体由白色变为黄色。 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
⑴4FeO·Cr2O3+8Na2CO3+7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
⑵2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是
A.反应⑴和⑵均为氧化还原反应
B.反应⑴的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移7mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学原理与应用有非常重要的意义。
(1)锌锰电池(俗称干电池) 是一种一次电池,生活中应用广泛。
①锌锰电池负极上的电极反应式为:______________________________。
②与普通(酸性)锌锰电池相比较,碱性锌锰电池的优点是____________________(回答一条即可)。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
①充电时阴极反应为:________________________________________。
②用铅蓄电池为电源进行电解饱和食盐水实验(石墨棒为阳极,铁为阴极,食盐水500mL,温度为常温),当电路中有0.05mol电子转移时,食盐水的pH为______(假设溶液体积不变,产物无损耗)。
(3)图1是金属(M)-空气电池的工作原理,我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池反应为:___________________________ 。

二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图2所示。Pt2上的电极反应式为:_______________________________________ 。
(4)高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,可以用电解法制取:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。
FeO42+3H2↑,工作原理如图所示。

装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。电解一段时间后,c(OH)降低的区域在_____________(填“阴极室”或“阳极室”);阳极反应为:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com