
【题目】下列各组物质中,都属于离子化合物的一组是
A.Na2O2 HBrB.Br2 Na2OC.KCl NaOHD.HF H2O
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了从海带中提取碘,某研究性学习小组设计并进行了如下实验:
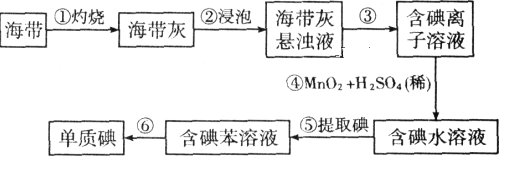
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是________(从下列仪器中选出所需仪器,用标号字母填写在横线上)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是__________ ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_____________。
(3)步骤④反应的离子方程式是____________________________________________
(4)步骤⑤中,某学生选择用苯来提取碘的理由是______________________________
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()

可能用到的有关数据如下:

Ⅰ.合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述正确的是
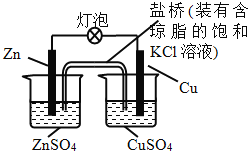
A. 盐桥中的K+移向ZnSO4溶液
B. 电流从锌片经导线流向铜片
C. 铜片质量逐渐减少
D. 铜离子在铜片表面被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
K、Fe、Ni均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
(1)K元素处于元素周期表的_____ 区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有______个。
(2)KCl 和NaCl 均为重要的化学试剂,KCl 的熔点低于NaCl的原因为___________。
(3)从原子结构角度分析,Fe3+比Fe2+更稳定的原因是__________。
(4)NiSO4 溶于氨水形成[Ni (NH3)6]SO4。
①写出一种与[Ni(NH3)6]SO4中的阴离子互为等电子体的分子的分子式_________。
②1mol[Ni(NH3)6]SO4中含有σ键的数目为___________。
③NH3 的VSEPR模型为_____ ;中心原子的杂化形式为_____,其杂化轨道的作用为__________。
(5)K、Ni、F三种元素组成的一种晶体的长方体晶胞结构如图所示。若NA为阿伏加德罗常数的值,该晶体的密度ρ=______g/cm3(用代数式表示)。
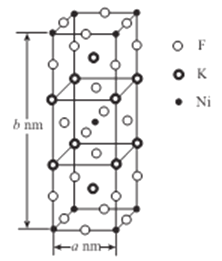
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
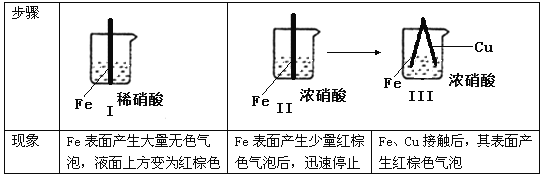
下列说法中不正确的是:
A. Ⅰ种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用石墨电极电解CuCl2溶液(如图)。
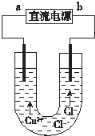
(1)下列分析正确的是_____________________________________________。
A. a端是直流电源的负极
B. 通电使CuCl2发生电离
C. 阳极上发生的反应:Cu2++2e-=Cu
D. 通电一段时间后,在阴极附近观察到黄绿色气体
(2)该同学不慎将一个石墨电极掉入CuCl2溶液中,并未取出,继续用石墨电极电解该溶液,如图所示:
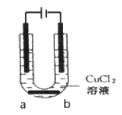
则电解一段时间后,石墨棒a端的现象是___________________________;石墨棒b端的电极反应是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一酸两浸,两碱联合”法是实现粉煤灰(含SiO2、Al2O3、Fe2O3、CaO、MgO等)综合利用的新工艺。工业流程如下:

回答下列问题:
(1)聚合氯化铝铁(PAFC)化学式为[Al2(OH)nCl6-n]m·[Fe2(OH)xCl6-x]y,是一种新型高效的净水剂,PAFC中铁元素的化合价为___________。
(2)“一酸两浸”中的酸是________________(填结构式)。
(3)实际工业中“酸浸”、“碱浸”均不能充分反应,滤渣A中主要含有SiO2、Al2O3。“纯碱混合焙烧”中,它们分别发生反应的化学方程式为_____________、 ________________。
(4)“滤液B”的主要溶质有_____________(填化学式)。滤液混合后“蒸发”的作用是____________________________________。
(5)“电解”时的化学方程式________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com