
| A. | 常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 | |
| C. | 将 0.001 mol•L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 | |
| D. | 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
分析 A.KSP只与温度有关,温度不变,则难溶物的溶度积不变;
B.溶度积越小,易溶于生成沉淀;
C.Qc与KSP差别越大,越容易生成沉淀;
D.向AgCl的饱和溶液中加入NaCl晶体,溶解平衡逆向移动,生成沉淀,c(Ag+)减小,c(Cl-)增大.
解答 解:A.KSP只与温度有关,与溶液中离子浓度无关,温度不变,则溶度积不变,故A错误;
B.KSP(AgCl)>KSP(AgI),沉淀转化为溶解度更小的物质容易发生,向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色,故B正确;
C.KCl和KI的混合溶液中,c(Cl-)和c(I-)的大小无法比较,所以Qc也无法知道,无法判断Qc与KSP差别大小,也就无法确定沉淀的先后顺序,故C错误;
D.向AgCl的饱和溶液中加入NaCl晶体,溶解平衡逆向移动,生成沉淀,c(Ag+)减小,c(Cl-)增大,c(Ag+)<c(Cl-),故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,题目难度中等,注意难溶物类型相同时,溶度积越小越容易生成沉淀,注意掌握难溶物溶解平衡及其影响因素,试题侧重考查学生的灵活应用能力


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种黄绿色的有毒气体 | |
| B. | 灼热的铜丝在氯气中燃烧,生成棕黄色的烟 | |
| C. | 可以用排饱和食盐水法收集氯气 | |
| D. | 氯水、液氯是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的Cu2O为1.44 g | |
| B. | 做氧化剂的硝酸为0.14 mol | |
| C. | 至少需0.5 moI/L硝酸140 mL与Cu2O反应 | |
| D. | 转移的电子总数为0.06 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该溶液的pH减小 | D. | 溶液的蓝色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
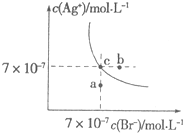 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 | |
| C. | 图中a点对应的是AgBr的不饱和溶液 | |
| D. | 向组成为c点的溶液中加入等体积的0.1 mol/L的氯化钠溶液,可产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
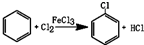
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
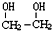 )是一种重要的化工原料,
)是一种重要的化工原料, (g)△H=a kJ/mol
(g)△H=a kJ/mol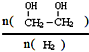 增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)
增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
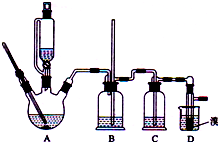 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com