
| A. | 平衡前,充入氮气,容器内压强增大,反应速率加快 | |
| B. | 平衡时,其他条件不变,分离出硫,逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度可提高 SO2 的转化率 | |
| D. | 其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变 |
分析 该可逆反应正反应是气体体积减小、放热反应,在反应达到平衡之前,容器内气体的压强在不断减小,分离出液体硫,不影响平衡移动,反应速率不变,平衡常数只与温度有关,与压强大小无关.
解答 解:A、平衡前,充入氮气,容器内压强增大,但是体积不变,组分的浓度不变化,反应速率不变,故A错误;
B、硫是液体,分离出硫,不影响平衡移动,气体反应物和生成物浓度都不变,所以不影响反应速率,故B错误;
C、平衡时,其他条件不变,升高温度,平衡逆向移动,所以SO2 的转化率减小,故C错误;
D、其他条件不变,缩小容器体积,增加压强,所以平衡正反应方向移动,但是平衡常数只与温度有关,与压强大小无关,反应的平衡常数不变,故D正确.
故选D.
点评 本题考查了影响化学平衡的因素,难度不大,易错选项是B,注意固体和纯液体改变用量对反应速率无影响.


科目:高中化学 来源: 题型:选择题
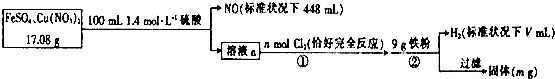
| A. | V=2240 | |
| B. | n=0.02 | |
| C. | 原混合物中FeS04的质量分数约为89% | |
| D. | m=0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
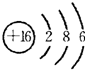 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
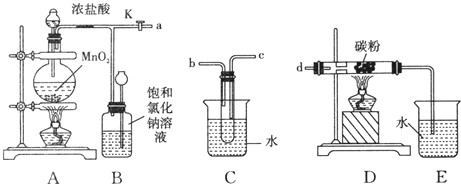
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只能是酸 | B. | 只能是碱 | ||
| C. | 可能是酸也可能是碱 | D. | 只能是盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1的AlCl3溶液 | B. | 20 mL 0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30 mL 0.2 mol•L-1的KCl溶液 | D. | 100 mL 0.25 mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

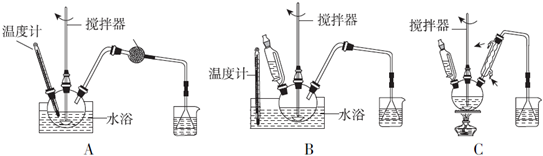
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B与A只能组成BA3化合物 | |
| B. | 第三周期中,D原子的原子半径最大 | |
| C. | A、B、C三元素不可能形成离子化合物 | |
| D. | E的氧化物对应水化物一定有强的氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com