
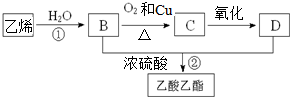
| 一定条件 |
| 浓硫酸 |
| △ |
| 一定条件 |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 4.48×108L |
| 22.4L/mol |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、在AgNO3溶液中依次滴加同浓度的NaCl、Na2S溶液,可证明KSP(AgCl)>KSP(Ag2S) |
| B、△S>0的反应在一定条件下不一定可以自发进行 |
| C、以Al作阳极,Fe作阴极,可以实现铁上镀铝 |
| D、工业合成SO3不采用高压是因为增大压强对SO2的转化率影响不大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
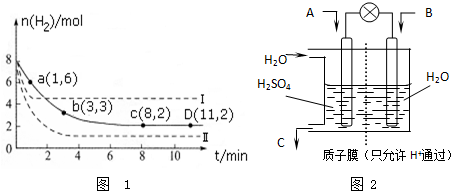
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物.请回答下列问题:
如图中A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
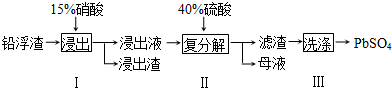
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3既能溶于NaOH溶液又能溶于HCl,说明Al2O3是两性氧化物 |
| B、浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 |
| C、SO2气体具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D、石英的主要成分是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
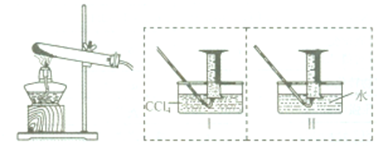
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com