
已知A、B、C、D、E五种短周期元素,A的最外层电子数是其电子层数的3 倍,A、B同主族,C在短周期主族元素中原子半径最大,E2是黄绿色气体,D为金属元素,其单质可以用于工业冶炼Fe。
(1)D在周期表中的位置是______ ;
A、B、C离子半径由大到小的顺序为______ 。(用离子符号回答)
(2)工业上用E的单质制备漂白粉的化学方程式为
_____ _____ ;
将少量C2A2加入水中可观察到的实验现象是 ;向所得溶液中加入酚酞可观察到溶液先变红后褪色,由此说明溶液中有______ (填化学式)两种物质生成。
(3)D与Fe2O3的反应还可以用于定向爆破,其化学反应方程式为
__ ___ ;
该反应为______(填“吸热”或“放热”)反应。
(4)常温下,将0.0025 mol的BA2E2溶于水配成0.1L溶液,所得溶液的pH= 1,则 BA2E2与水反应的化学方程式为_______ _____。
(1)第三周期第ⅢA族;S2->O2->Na+;
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;浅黄色固体溶解,有无色无味的气体产生;NaOH、H2O2;
(3)2Al+Fe2O3 2Fe+Al2O3;放热;
2Fe+Al2O3;放热;
(4)SO2Cl2+2H2O=H2SO4+2HCl;
解析试题分析:A、B、C、D、E五种短周期元素,A的最外层电子数是其电子层数的3倍,则A有2个电子层,最外层电子数为6,故A为氧元素,A、B同主族,则B为硫元素;C在短周期主族元素中原子半径最大,则C为Na元素;E2是黄绿色气体,为氯气,则E为Cl元素,D为金属元素,其单质可以用于工业冶炼Fe,则D为Al元素,
(1)D为Al元素,原子核外有3个电子层,最外层电子数为3,在周期表中的位置是第三周期第ⅢA族,电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大,故离子半径S2->O2->Na+;
(2)工业上用Cl2制备漂白粉的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,将少量Na2O2加入水中,过氧化钠与水反应生成氢氧化钠与氧气,可观察到的实验现象是:淡黄色固体溶解,有无色无味的气体生成,向所得溶液中加入酚酞可观察到溶液先变红后褪色,说明有碱及强氧化性物质生成,应是NaOH、H2O2;
(3)Al与Fe2O3的反应用于定向爆破,反应方程式为Al+Fe2O3 Fe+Al2O3;
Fe+Al2O3;
(4)常温下,将0.0025mol的SO2Cl2溶于水配成0.1L溶液,所得溶液的pH=1,SO2Cl2水解应生成H2SO4、HCl,则SO2Cl2与水反应的化学方程式为:SO2Cl2+2H2O=H2SO4+2HCl。
考点:原子结构与元素周期率的关系


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:填空题
A、B、M、D、E是原子序数依次增大的五种短周期元素。A元素的一种原子中不含中子。B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍。试回答: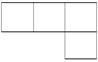
(1)A元素是________ 。
(2)在B、M、D、E四种元素的最简单氢化物中,沸点最高的是__________(填化学式)。
(3)A、B、M、D可组成多种18电子分子,写出 2种具有18电子的有机物的结构简式______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
| | | | ||||||
| | | | | | | A | B | |
| C | | | D | E | F | G] | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D四种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的价电子排布为ns2πp2n,D在空气中燃烧可以得到淡黄色固体。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
(1)D在元素周期表中的位置是 。
(2)比较元素B和C的第一电离能:B C(填“大于”、“小于”或“不确定”),将BA3通入溴水中可发生反应,生成B的单质和一种盐Y,B的单质中的σ键和π键个数比为 ,盐Y的晶体类型是 。
(3)D与A形成的粒子个数比为1:1的简单化合物可与水反应生成A的单质,该反应的化学方程式为 。
(4)已知B2A4和过氧化氢混合可作火箭推进剂。12.8g液态B2A4与足量过氧化氢反应生成B的单质和气态水,放出256.65kJ的热量:
写出液态B2A4和氧气反应生成B的单质和液态A2C的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | | ⑤ | | | ⑥ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表列出了A~G7种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | C | D | E | | |
| 3 | | | B | | | | F | G |
| 4 | A | | | | | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A形成的单质密度最小(相同条件下)。B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)元素C位于元素周期表的 周期 族,原子结构示意图为 。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是 (填化学式),BE4分子的空间构型是 。
(3)元素A与B形成原子个数比为1:1的相对分子质量最小的化合物的结构式为 。
(4)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒之间反应的其中一个化学方程式或离子方程式:
(5)写出E的单质制取漂白粉反应的化学方程式并标出电子转移的方向和数目:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能——甲醇。
(1) 与CO互为等电子体的物质的化学式是 。
(2) CO2分子中碳原子的杂化类型是 杂化。
(3) 按电子排布Zn在元素周期表中属于 区,
其晶体属于六方最密堆积,它的配位数是 。
(4) Cu的一种氯化物晶体的晶胞结构如图所示。(空心球代表氯离子),则一个晶胞中所含的数目是 。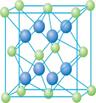
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素D在周期表中的位置是 。
(2)该配位化合物的化学式为 。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61×10-8cm,则E的密度为 ;EDC4常作电镀液,其中DC 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。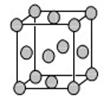
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com