
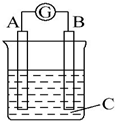
| A. | A是Zn,B是Cu,C是稀硫酸 | B. | A是Cu,B是Zn,C是稀硫酸 | ||
| C. | A是Fe,B是Ag,C是稀AgNO3溶液 | D. | A是Ag,B是Fe,C是稀AgNO3溶液 |
分析 原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加,据此分析.
解答 解:该原电池中,A极逐渐变粗,B极逐渐变细,所以B作负极,A作正极,B的活泼性大于A的活泼性,所以排除AC选项;
A极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,D选项析出金属,所以D符合题意.
故选D.
点评 本题考查了原电池原理,难度不大,明确正负极的判断方法,注意不能仅根据金属的活泼性判断正负极,要根据发生反应的反应类型判断正负极,如:Mg、Al、NaOH溶液构成的原电池,铝作负极,镁作正极.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 将反应2Fe3++Cu═2Fe2++Cu2+设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液.
将反应2Fe3++Cu═2Fe2++Cu2+设计成如图所示原电池,可供选择的电解质溶液有FeCl3、CuSO4两种溶液.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂为I2 | |
| C. | 该反应中还原剂为KClO3 | |
| D. | 该反应中KClO3被还原为Cl2,I2被氧化为KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
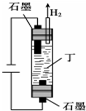 6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:| X | Y | Z | |
| W | M | Q |
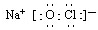 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
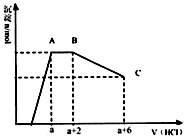 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图,下列说法中不正确的是( )| A. | 原溶液肯定含有OH-,CO32-,AlO2-,SiO32- | |
| B. | K+和Na+至少含有其中一种 | |
| C. | n(CO32-):n(AlO2-)=3:2 | |
| D. | a值肯定大于$\frac{4}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
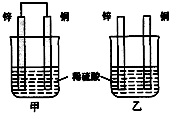 (1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)已知:△H>0为吸热反应、△H<0为放热反应.实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
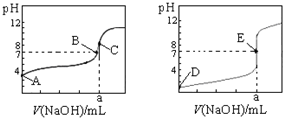 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 如图是滴定盐酸的曲线 | |
| B. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | E点时溶液中离子浓度为c(Na+)=c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的分子大小不同 | B. | 气体分子间的平均距离不同 | ||
| C. | 气体的性质不同 | D. | 气体的物质的量不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com