
分析 (1)①FeS2中$\frac{2}{3}$的+2价Fe变为+3价Fe,-1价S变为0价,C由0价变为+2价,O由0价变为-2价,因此一个FeS2化合价升高$\frac{8}{3}$价,一个C化合价升高2价,一个O2化合价降低4价,O2得电子总数有3/4来自于C可知C与O2的化学计量数之比为3:2,FeS2的化学计量数为$\frac{3}{4}$,然后根据原子守恒配平并使化学计量数为正整数;
②根据硫元素的质量守恒进行计算;
(2)S8在充足的空气中燃烧生成二氧化硫;
(3)生成淡黄色沉淀是S,放出的气体能使品红溶液褪色,该气体是二氧化硫,写出反应物离子和生成物,然后配平;
(4)①在电解池中,阳极上发生氧化反应,SO42-在阳极放电生成S2O82-;
②Mn2+~MnO4-,化合价升高5,S2O82-~2SO42-,化合价降低2×1,根据得失电子守恒计算.
解答 解:(1)①FeS2中$\frac{2}{3}$的+2价Fe变为+3价Fe,-1价S变为0价,C由0价变为+2价,O由0价变为-2价,因此一个FeS2化合价升高$\frac{8}{3}$价,一个C化合价升高2价,一个O2化合价降低4价.由O2得电子总数有3/4来自于C,可知C与O2的化学计量数之比为3:2,假定C的化学计量数为3,O2的化学计量数为2,则FeS2的化学计量数为$\frac{4×2×(1-\frac{3}{4})}{\frac{8}{3}}$=$\frac{3}{4}$,然后化学计量数均扩大四倍,根据原子守恒可得3FeS2+12C+8O2═Fe3O4+12CO+6S,
故答案为:3;12;8;1;12;6;
②m吨黄铁矿中含有硫元素的质量为m×a%×$\frac{64}{120}$吨,在炼焦炉中硫的损失后剩余m×a%×$\frac{64}{120}$(1-b%)吨,
故答案为:m×a%×$\frac{64}{120}$(1-b%);
(2)S8在充足的空气中燃烧生成二氧化硫,化学方程式为S8+8O2$\frac{\underline{\;点燃\;}}{\;}$8SO2,
故答案为:S8+8O2$\frac{\underline{\;点燃\;}}{\;}$8SO2;
(3)硫代硫酸钠晶体遇酸反应生成淡黄色沉淀是S,放出的气体能使品红溶液褪色,该气体是二氧化硫,离子方程式为S2O32-+2H+=S↓+SO2↑+H2O,
故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(4)①在电解池中,阳极上发生氧化反应,SO42-在阳极放电生成S2O82-,因此阳极电极反应式为2SO42--2e-=S2O82-,
故答案为:2SO42--2e-=S2O82-;
②Mn2+~MnO4-,Mn化合价升高5,S2O82-~2SO42-,一个S2O82-中S的合价共降低2×1,设1mol S2O82-氧化Mn2+可制得x mol MnO4-,根据得失电子守恒,
1mol×2=5×x mol,解得x=0.4,
故答案为:0.4.
点评 本题考查了氧化还原反应的应用,综合性很强,题目难度很大,涉及氧化还原反应的配平、依据得失电子相等的计算、方程式的书写等问题,其中(1)配平难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 2.4 g 金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 常温常压下,8.0g CH4中含有的价电子总数为5NA | |
| C. | 在标准状况下,22.4 L CH4与NH3混合气所含有的质子总数为10NA | |
| D. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率为“1 mol/(L•min)”表示的意思是:时间为1 min 时,某物质的浓度为1 mol/L | |
| D. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
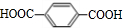 +2NaHCO3→
+2NaHCO3→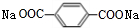 +2H2O+2CO2↑.
+2H2O+2CO2↑.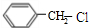 .
.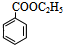 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$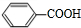 +CH3CH2OH.
+CH3CH2OH.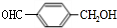 ,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n
,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n +n
+n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$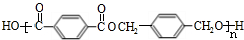 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
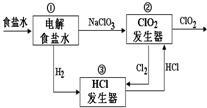 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.| A. | 该流程中仅NaCl可循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②中Cl2是还原产物 | |
| D. | 为使H2完全转化为HCl,还应向装置③中再补充Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
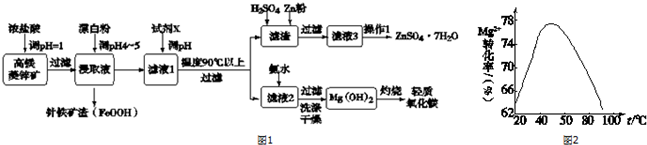
| Zn2+ | Mg2+ | Cu2+ | Fe3+ | Fe2+ | |
| 开始沉淀pH | 5.9 | 9.4 | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 8.2 | 12.4 | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
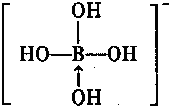 .(若存在配位键需标出)
.(若存在配位键需标出)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
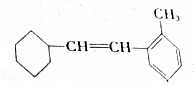 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com