
 ��
��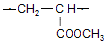 ��
�� $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$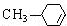 +H2O��
+H2O�� ��
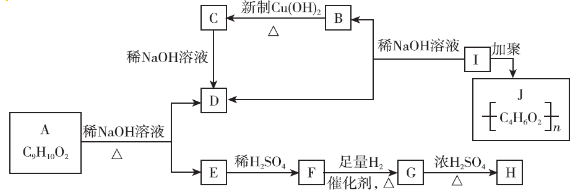
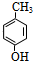
������ ��I�����Ӿ۷�Ӧ���ɣ�C4H6O2��n����֪I�ķ���ʽΪC4H6O2��I����������ˮ��Һ����������������B��D��B��������C��C��ϡ���������Ʒ�Ӧ����D����IΪ����BΪȩ��DΪ�������Σ���B��C��D������ͬ��̼ԭ����ĿΪ2��I�IJ����Ͷ�Ϊ$\frac{2��4+2-6}{2}$=2����I�����л�����1��C=C˫������BΪCH3CHO��CH2=CHOH���ȶ�����CΪCH3COOH��DΪCH3COONa��IΪCH3COOCH=CH2���л���A�ķ���ʽΪC9H10O2�������Ͷ�Ϊ$\frac{2��9+2-10}{2}$=5�����Ǻ��б�����A����������ˮ��Һ����������������D��E��E�ữ�õ�F����F����������������Ӧ����G����ӦG��H�У��л���Hֻ��һ�ֽṹ����ʹ��ˮ��ɫ��˵��H�к���̼̼˫��������G�к����ǻ���DΪCH3COONa��D�в����������л���A���Ǻ��б�����A����������ˮ��Һ����������������D��E��˵��G���б�������F���з��ǻ�����A������������γɵ���������A�к���1��������1����������Ϸ���ʽ��֪��Ӧ��������������γɵ�������FΪ�����ӣ�F�����������ӳɷ�Ӧ����GΪ�����������л���Hֻ��һ�ֽṹ����ʹ��ˮ��ɫ��G������ȥ��Ӧ����H����F�м�����ǻ����ڶ�λ�����Ϸ�����֪��AΪ ����EΪ
����EΪ ��FΪ
��FΪ ��GΪ
��GΪ ��HΪ
��HΪ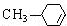 ���ݴ˽��
���ݴ˽��
��� �⣺��1����I�����Ӿ۷�Ӧ���ɣ�C4H6O2��n����֪I�ķ���ʽΪC4H6O2��I����������ˮ��Һ����������������B��D��B��������C��C��ϡ���������Ʒ�Ӧ����D����IΪ����BΪȩ��DΪ�������Σ���B��C��D������ͬ��̼ԭ����ĿΪ2��I�IJ����Ͷ�Ϊ$\frac{2��4+2-6}{2}$=2����I�����л�����1��C=C˫������BΪCH3CHO��CH2=CHOH���ȶ������л���A�ķ���ʽΪC9H10O2�������Ͷ�Ϊ$\frac{2��9+2-10}{2}$=5�����Ǻ��б�����A����������ˮ��Һ����������������D��E��E�ữ�õ�F����F����������������Ӧ����G����ӦG��H�У��л���Hֻ��һ�ֽṹ����ʹ��ˮ��ɫ��˵��H�к���̼̼˫��������G�к����ǻ���DΪCH3COONa��D�в����������л���A���Ǻ��б�����A����������ˮ��Һ����������������D��E��˵��G���б�������F���з��ǻ�����A������������γɵ���������A�к���1��������1����������Ϸ���ʽ��֪��Ӧ��������������γɵ�������FΪ�����ӣ�F�����������ӳɷ�Ӧ����GΪ�����������л���Hֻ��һ�ֽṹ����ʹ��ˮ��ɫ��G������ȥ��Ӧ����H����F�м�����ǻ����ڶ�λ��FΪ ��
��
�ʴ�Ϊ��CH3CHO�� ��
��
��2���߷��ӻ��������ظ����ֵĽṹ��Ԫ�����ڣ��߾���JΪ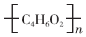 ���ṹ��ʽΪ
���ṹ��ʽΪ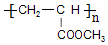 ������Ϊ
������Ϊ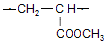 ��
��
�ʴ�Ϊ��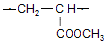 ��
��
��3��GΪ ��HΪ
��HΪ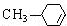 ��G��H�Ǵ���������ȥ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ��
��G��H�Ǵ���������ȥ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ�� $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$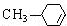 +H2O��
+H2O��
�ʴ�Ϊ�� $��_{��}^{Ũ����}$
$��_{��}^{Ũ����}$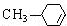 +H2O��
+H2O��
��4��AΪ ��EΪ
��EΪ ��DΪCH3COONa��A��E+DΪ����ˮ�⣬��Ӧ�Ļ�ѧ��Ӧ����ʽΪ��
��DΪCH3COONa��A��E+DΪ����ˮ�⣬��Ӧ�Ļ�ѧ��Ӧ����ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
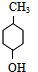
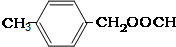
��5��AΪ ���������࣬������A������ͬ�����ţ����жԶ�ȡ�������ṹ����
���������࣬������A������ͬ�����ţ����жԶ�ȡ�������ṹ����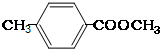 ��
��
��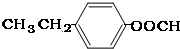 ���ʹ���3�֣�
���ʹ���3�֣�
�ʴ�Ϊ��3��
���� ���⿼���л�����ƶϣ�����I�ļӾ۲���ȷ��I�ķ���ʽ�����ݷ�Ӧ�����ж�I���еĹ����ţ�����ȷ��I�Ľṹ��ʽ������A�ķ���ʽ�뷴Ӧ�����ж�A���еĹ����ţ����E��H��ϵ��ת���ۺϷ���ȷ��A�Ľṹ���ܽϺõĿ��鿼������ѧ�����ͷ���������������Ŀ�Ѷ��еȣ�


 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д� ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3COO-��Cl-��NH4+��SO42- | B�� | Mg2+��Cl-��Na+��NO3- | ||
| C�� | K+��MnO4-��NO3-��Fe2+ | D�� | Na+��SO42-��HCO3-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 25��ʱ����֪AgCl��Ksp=1.8��10-10��Ag2CO3��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵��������ǣ�������
25��ʱ����֪AgCl��Ksp=1.8��10-10��Ag2CO3��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵��������ǣ�������| A�� | Ag2CO3��KspΪ8.1��10-12 | |
| B�� | Ag2CO3��s��+2Cl-��aq��?2AgCl��s��+CO32-��aq��ƽ�ⳣ��K=2.5��108 | |
| C�� | ��Ag2CO3�ı�����Һ�м���K2CO3��s����ʹc��CO32-��������Y�㵽Z�㣩 | |
| D�� | ��0.001mol•L-1AgNO3��Һ�е���ͬŨ�ȵ�KCl��K2CO3�Ļ����Һ��CO32-�ȳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH3OH | CH3OCH3 | H2O |
| c/mol•L-1 | 0.44 | 0.60 | 0.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
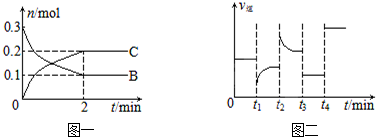
| A�� | t2ʱ�ı����������������c��C����ƽ��ʱB�����ʵ����������� | |
| B�� | t1ʱ�ı�������ǽ��£�ƽ�������ƶ� | |
| C�� | t3ʱ�����Ǽ�Сѹǿ��ƽ�ⲻ�ƶ���t4ʱ������ʹ�ô�����c��B������ | |
| D�� | x=2����Ӧ��ʼ2 min�ڣ�v��B��=0.1 mol/��L•min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯ�������� | B�� | ��̪����ɫ��ȥ | C�� | ���ȣ��ɻƱ�� | D�� | ���ȣ��ɳȱ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com