
【题目】实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。下列说法中,不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. 浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
【答案】C
【解析】
将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到氢氧化镁和氯化钠以及剩余氢氧化钠的混合物,加入FeCl3溶液,会出现红褐色沉淀氢氧化铁,氢氧化镁的选浊液中滴加氯化铁会生成氢氧化铁沉淀,沉淀向着更难溶的物质转化,氯化铵会对氢氧化镁的沉淀溶解平衡产生影响。
将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到氢氧化镁和氯化钠以及剩余氢氧化钠的混合物,氢氧化镁存在沉淀溶解平衡: Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),
Mg2+(aq)+2OH-(aq),
A、将①中所得浊液氢氧化镁过滤,氢氧化镁存在沉淀溶解平衡: Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),所得滤液中含少量Mg2+,所以A选项是正确的;
Mg2+(aq)+2OH-(aq),所得滤液中含少量Mg2+,所以A选项是正确的;
B、浊液中存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),所以B选项是正确的;
Mg2+(aq)+2OH-(aq),所以B选项是正确的;
C、实验②中是因为剩余的氢氧化钠和氯化铁之间反应生成氢氧化铁的缘故,不能说明Fe(OH)3比Mg(OH)2难溶,故C错误;
D、氢氧化镁存在沉淀溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),加氯化铵,会和氢氧根离子之间反应,所以平衡正向移动,沉淀溶解,所以D选项是正确的。
Mg2+(aq)+2OH-(aq),加氯化铵,会和氢氧根离子之间反应,所以平衡正向移动,沉淀溶解,所以D选项是正确的。
答案选C。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
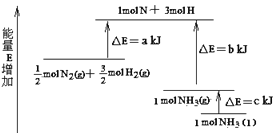
A.N2(g)+3H2(g)=2NH3(l) △H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)=2NH3(g) △H=2(b-a)kJ/mol
C.1/2 N2(g)+3/2H2(g)=NH3(l) △H=(b+c-a)kJ/mol
D.1/2 N2(g)+3/2H2(g)=NH3(g) △H=(a+b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3丙二醇是生产新型高分子材料PTT的主要原料,目前,1,3丙二醇的生产路线有:以石油裂解气为原料的两条石油化工合成路线和一条生物工程法合成路线。
(路线1)丙烯醛水合氢化法:CH2=CHCH3![]() CH2=CHCHO―→
CH2=CHCHO―→![]()
![]() HO-CH2CH2CH2-OH
HO-CH2CH2CH2-OH
(路线2)环氧乙烷甲酰化法:
![]()
![]() HO-CH2CH2CH2-OH
HO-CH2CH2CH2-OH
(路线3)生物发酵法:淀粉![]() 甘油
甘油![]() 1,3丙二醇
1,3丙二醇
(1)A的结构简式为_________________。
(2)从合成原料来源的角度看,你认为最具有发展前景的路线是_____(填“1”、“2”或“3”),理由是___________。
(3)以1,3丙二醇与对苯二甲酸为原料可以合成聚酯PTT,写出其化学方程式________。
(4)已知丙二酸二乙酯能发生以下反应:
CH2(COOC2H5)2![]() CH3CH(COOC2H5)2
CH3CH(COOC2H5)2![]()
![]() 利用该反应原理,以丙二酸二乙酯、1,3丙二醇、乙醇为原料合成
利用该反应原理,以丙二酸二乙酯、1,3丙二醇、乙醇为原料合成![]() ,请你设计出合理的反应流程图。________
,请你设计出合理的反应流程图。________
提示①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
A![]() B
B![]() C……
C……
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是( )
A.中子数为20的氯原子:20Cl
B.乙酸乙酯的结构简式:CH3CH2OOCCH3
C.甲醛的电子式: ![]()
D.2,4,6-三硝基甲苯的结构简式: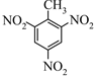
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定0.100mol/L浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
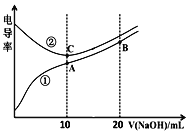
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+)>c(OH-)>c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
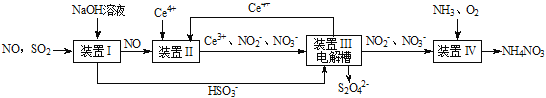
(1)装置Ⅰ中生成HSO3-的离子方程式为_____ 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
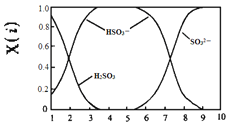
①下列说法正确的是_____(填字母序号)。
A.pH=8时,溶液中c(HSO3-) <c(SO32-)
B.pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:_____。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式____。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

①生成Ce4+的电极反应式为_________。
②生成Ce4+从电解槽的_____(填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要的有机合成中间体,它的合成路线如下:
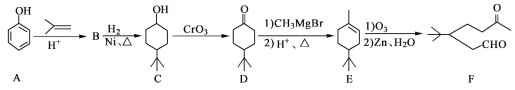
(1)化合物F中含氧官能团的名称是_________和_________。
(2)由B生成C的化学反应类型是________。
(3)写出化合物B的结构简式:__________。
(4)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢。写出该化合物的结构简式:__________(任写一种)。
(5)请根据已有知识并结合相关信息,写出以苯酚(![]() )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物![]() 的合成路线流程图_____________________________(无机试剂任用)。
的合成路线流程图_____________________________(无机试剂任用)。
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
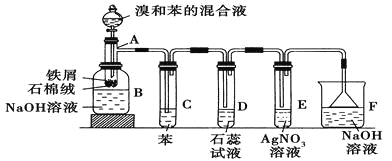
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):________________________。
(2)试管C中苯的作用是 。反应开始后,观察D和E两试管,看到的现象分别为 、 。
(3)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是 。
(4)在上述整套装置中具有防倒吸作用的仪器有 (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于______。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是______。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是______。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。
(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com