
【题目】常温下,CaSO4(s)+CO32-![]() CaCO3(s)+SO42-的平衡常数K=1.75×104,已知常温下,饱和CaSO4溶液中c( Ca2+) = 0.70×10-2mol/L,则常温时CaCO3的Ksp为
CaCO3(s)+SO42-的平衡常数K=1.75×104,已知常温下,饱和CaSO4溶液中c( Ca2+) = 0.70×10-2mol/L,则常温时CaCO3的Ksp为
A. 2.50×10-8 B. 0.40×10-6
C. 2.80×10-9 D. 0.4×10-9
科目:高中化学 来源: 题型:
【题目】一定条件下,利用如图装置可实现有机物的储氢,下列有关说法正确的是( )
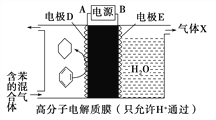
A. 苯在电极D放电时断开的化学键是极性键
B. 气体X在反应中通常体现还原性
C. 若阳极区的电解质溶液为稀硫酸,则电解一段时间后,阳极区溶液的pH增大
D. 电极D的电极反应式为C6H6+6H++6e-===C6H12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系且正确的是( )
A. Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
B. 明矾溶于水能形成胶体,可用于自来水的杀菌消毒
C. 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
D. 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,同学们用以下实验的进行探究。
(1)实验一:经研究知Fe3+、Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验(其它实验条件相同)。
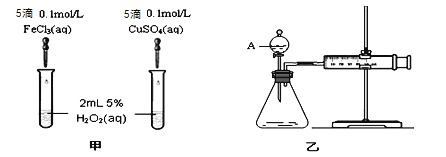
①定性分析:如图甲可通过观察产生气泡的快慢来比较反应速率的大小,比较得出结论。若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好 (填“能”或“否”),其理由是____________________(若能说明催化效果,此空不填) 。
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。用简单的方法检验该装置的气密性 。实验中需要测量的数据是: 。
(2)实验二:高锰酸钾酸性(稀硫酸酸化)溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
① 写出酸性高锰酸钾溶液和草酸溶液反应的化学方程式: 。
②针对上述实验现象,某同学认为KMnO4与草酸的反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。(填序号)
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(3)实验三 已知 KI溶液在酸性条件下能与氧气反应。 现有以下实验记录:
实验编号 | ① | ② | ③ | ④ | ⑤ |
温度(℃) | 30 | 40 | 50 | 60 | 70 |
显色时间(s) | 160 | 80 | 40 | 20 | 10 |
① 该反应的离子方程式为_____________________。
② 完成此实验,试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是______________,
实验现象为 。
③ 由上述实验记录数据可得出的结论是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为短周期内原子半径依次增大的元素,X、 Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、 乙为其中两种元素对应的单质。若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是

A. 相对分子质量M>N,沸点N>M
B. 简单离子半径:C2—>B2—>D+>A+
C. A、C、D的常见氧化物相互之间一定能反应
D. D与其他元素均能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞内化合物的描述,错误的是
A. 中心体和核糖体无膜结构,有N元素
B. 组成酶的基本单位之间都是通过肽键连接的
C. 淀粉和糖原分子结构不同主要是由于它们的空间结构不同
D. 参与构成ATP分子和RNA分子的五碳糖相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某元素+2价离子的电子排布式为1s22s22p63s23p6,该元素在周期表中属于( )
A. ⅤB族 B. ⅡB族 C. Ⅷ族 D. ⅡA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com