
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:选择题
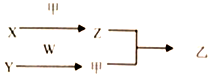 短周期元素A、B、C、D的原子序数依次增加.X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体.上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是( )
短周期元素A、B、C、D的原子序数依次增加.X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体.上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是( )| A. | 原子半径:D>C>B>A | |
| B. | C、D的氢化物均为共价化合物 | |
| C. | 相对分子质量W>X,沸点W>X | |
| D. | B的氢化物常温下一定为气态,C的氢化物常温下为液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
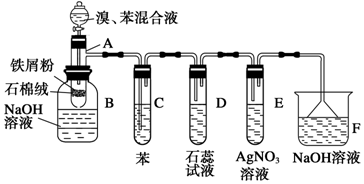
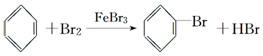
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:3:1 | B. | 3:2:1 | C. | 6:3:1 | D. | 9:4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
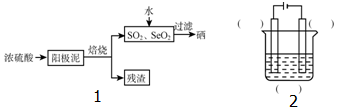
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
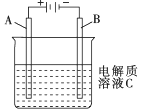 (1)肼(N2H4)又称联氨,是一种可燃性液体,可用作燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,反应生成一种可以参与大气循环的气体.该电池放电时,负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑.
(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,反应生成一种可以参与大气循环的气体.该电池放电时,负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制10%的ZnSO4溶液,将l0gZnSO4溶解于90g水中 | |
| B. | 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出 | |
| C. | NaCl溶液蒸发结晶时,蒸发血中有晶体析出并剩余少量液体时即停止加热 | |
| D. | 检验蔗糖水解产物具有还原性时,先向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
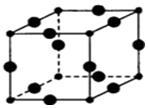 (1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.
(1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.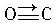 与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).
与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).| 晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3 401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com