
下列实验操作及装置合理并能达到实验目的是( )
|
| A. |
制取并收集氨气 |
|
| B. | . 收集并测定氧气的体积 |
|
| C. | . 制乙酸乙酯 |
|
| D. | . 用苯分离出碘水中的碘单质 |
考点:
化学实验方案的评价;物质的分离、提纯的基本方法选择与应用;排气量气装置;氨的制取和性质;乙酸乙酯的制取.
专题:
实验评价题.
分析:
A.氯化铵和氢氧化钙反应生成氨气,氨气的密度小于空气的密度,但氨气不能排放在空气中;
B.测定氧气的体积,导管应短进长出;
C.乙醇和乙酸在浓硫酸作用下加热发生酯化反应生成乙酸乙酯,饱和碳酸钠可除杂并降低乙酸乙酯的溶解度;
D.苯分离出碘水中的碘单质,需萃取、分液.
解答:
解:A.反应原理及收集方法均合理,但收集氨气时试管口应放一团浸有稀硫酸的棉花团,防止氨气逸出,故A错误;
B.测定氧气的体积,导管应短进长出,图中排水时长导管进不能排出水,故B错误;
C.乙醇和乙酸在浓硫酸作用下加热发生酯化反应生成乙酸乙酯,饱和碳酸钠可除杂并降低乙酸乙酯的溶解度,装置合理,故C正确;
D.苯分离出碘水中的碘单质,需萃取、分液,图中为过滤装置,故D错误;
故选C.
点评:
本题考查化学实验方案的评价,为高频考点,涉及气体的制备、收集及有机物制备、混合物分离提纯等,把握实验原理及实验装置的作用为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
常温下,在27.5g水中溶解12.5g CuSO4•5H2O,恰好达到饱和,该溶液密度为1.21g/cm3.求:
(1)该溶液中阴阳离子的总物质的量;
(2)该溶液中CuSO4的物质的量浓度;
(3)取出20.0mL该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
(计算结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列三个反应:①Cl2+FeI2═FeCl2+I2 ②2Fe2++Br2═2Fe3++2Br﹣③Co2O3+6HCl═2CoCl2+Cl2↑+3H2O.下列说法正确的是( )
|
| A. | ①②③中的氧化产物分别是I2、Fe3+、CoCl2 |
|
| B. | 根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 |
|
| C. | 可以推理得到Cl2+FeBr2═FeCl2+Br2 |
|
| D. | 在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
|
| A. | 14g分子通式为CnH2n的链烃中含有的C═C的数目为 |
|
| B. | 标准状况下,NO和 O2各11.2L 混合,所得混合气体的分子总数为 0.75NA |
|
| C. | 25℃时,pH=7的NH4Cl和NH3•H2O混合溶液中,OH﹣离子数为10﹣7NA |
|
| D. | 两份2.7g铝分别与100mL浓度为2mol•L﹣1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是( )
① ②
②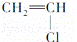 ③
③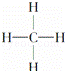 ④
④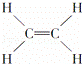 ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑧硬脂酸甘油酯、⑨蛋白质、⑩聚乙烯.
|
| A. | 能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩ |
|
| B. | 投入钠能产生H2的是⑤⑦⑧⑨ |
|
| C. | 属于高分子材料的是⑧⑨⑩ |
|
| D. | 含碳量最高、有毒、常温下为液体且点燃时有浓烟的是① |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸铁的组成可表示为xFe2(CO3)3•yFe(OH)3•zH2O.某化学兴趣小组完成以下实验目的: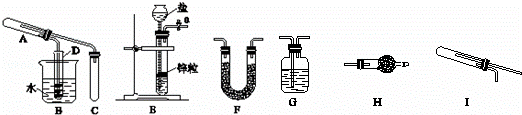
(1)探究碱式碳酸铁完全分解后的残留固体是否可使乙醇(已知乙醇的沸点为78℃)发生去氢氧化,并检验反应产物.如图已装配好一套装置,回答下列问题:
①该装置用于进行实验需加热的仪器有(选填序号字母) ;
②若在试管A中观察粉末由红色变成黑色,试管D银氨溶液中观察到试管壁内产生银镜,可以得出的结论是 ;写出A中发生的化学方程式 ;
③为确保反应物有较高的利用率,且使装置中气流平稳,应对C部分进行的改进 .
(2)请从上图中选择适当的装置采用氢气还原法测定碱式碳酸铁组成:
①如何检验E装置的气密性? ;
②该兴趣小组的同学设计的实验装置连接顺序为:E→G→G→I→G→F→H,则:第1、3次使用G装置的作用分别是 , ;H装置的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的用途错误的是( )
|
| A. | 晶体硅是制造太阳能电池的常用材料 |
|
| B. | 二氧化硅是制造光导纤维的材料 |
|
| C. | 氢氟酸可用刻蚀玻璃 |
|
| D. | 硅是制取水泥的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素R、Q、M、T在元素周期表中的相对位置如表,已知R原子最外层电子数与次外层电子数之比为2:1.
| R | Q | ||
| M | T |
(1)人的汗液中含有T的简单离子,其离子结构示意图为 ; 元素M在元素周期表中的位置是 .
(2)R的最高价氧化物所含的化学键类型是 键(选填“离子”或“共价”).
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为 (用具体的化学式表示).
(4)在一定条件下甲、乙、丙有如下转化:甲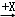 乙
乙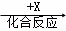 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是 (选填序号).
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是 (选填序号).
①R ②Q2 ③M ④T2
(5)元素T的含氧酸HTO具有漂白性写出HTO的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 需要加热方能发生的反应一定是吸热反应 |
|
| B. | 放热反应在常温条件下一定很容易发生 |
|
| C. | 反应是吸热还是放热的,必须看反应物和生成物所具有总能量的大小 |
|
| D. | 灼热的炭与二氧化碳的反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com