
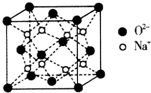
 H、C、N、O、Na、Fe、Cu是常见的七种元素.
H、C、N、O、Na、Fe、Cu是常见的七种元素.| m |
| V |
| 6+3-1 |
| 2 |
| 6+2 |
| 2 |
| 5-1 |
| 2 |
| 5+1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| m |
| ρ |
| ||
| ρ |
| 248 |
| ρ?NA |
| 3 |
| ||
| 3 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、应量取的浓盐酸的体积是9.6mL |
| B、若开始时洁净的容量瓶中有少许蒸馏水,对实验没有影响 |
| C、量取浓盐酸时,仰视量筒将使所配溶液的浓度偏低 |
| D、定容摇匀后,发现液面低于刻度线,应立即加少量蒸馏水补齐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强酸性溶液中:Na+,Fe2+,Cl-,ClO- |
| B、加入Al能放出的H2溶液中:Cl-,HCO3-,NO3-,NH4+ |
| C、在由水电离出的c(OH-)=10-13mol?L-1的溶液中:Fe2+,Al3+,NO3-,Cl- |
| D、pH=11的溶液中:CO32-,Na+,[Al(OH)4]-,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
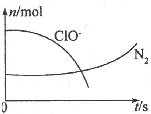 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2、ClO-的物质的量随时间变化的曲线如右图所示.下列判断不正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2、ClO-的物质的量随时间变化的曲线如右图所示.下列判断不正确的是( )| A、该反应的氧化剂是ClO- |
| B、消耗1 mol还原剂,转移3 mol电子 |
| C、氧化剂与还原剂的物质的量之比为2:3 |
| D、反应后溶液的酸性明显增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com