
 已知同温同压下烃A的密度与N2相同,C可发生银镜反应.它们之间的转化关系如图(部分反应条件和产物略去).请回答:
已知同温同压下烃A的密度与N2相同,C可发生银镜反应.它们之间的转化关系如图(部分反应条件和产物略去).请回答:分析 同温同压下烃A的密度与N2相同,则A的摩尔质量为28g/mol,C可发生银镜反应,则C为醛,由流程图可知,A氧化生成C,C氧化生成B,乙酸乙酯分解生成A与B,则A为CH2=CH2,C为CH3CHO,B为CH3COOH,反应④是一定条件下乙酸乙酯与H2发生的还原反应,符合绿色化学要求,实现了零排放,则D为CH3CH(OH)OCH2CH3,以此来解答.
解答 解:(1)B为CH3COOH,官能团为羧基,
故答案为:羧基;
(2)反应①为裂解反应,以C4H10为代表物,由原子守恒可知高温裂解生成A和另一种烃的化学方程式为C4H10$\stackrel{高温}{→}$CH2=CH2+CH3CH3,
故答案为:C4H10$\stackrel{高温}{→}$CH2=CH2+CH3CH3;
(3)反应④是一定条件下乙酸乙酯与H2发生的还原反应,符合绿色化学要求,实现了零排放.该反应的化学方程式为CH3COOCH2CH3+H2$\stackrel{一定条件}{→}$CH3CH(OH)OCH2CH3,
故答案为:CH3COOCH2CH3+H2$\stackrel{一定条件}{→}$CH3CH(OH)OCH2CH3;
(4)A.①〜⑤中,①③为分解反应,④为还原反应,共涉及到2个氧化反应,故A错误;
B.C为CH3CHO,D为CH3CH(OH)OCH2CH3,乙醛具有刺激性气味,不用任何试剂就能区分C和D,故B正确;
C.乙酸乙酯和有机物B的混合物,不分层,不能直接通过分液的方法分离,应加饱和碳酸钠溶液反应后分液,故C错误;
D.相同条件下,乙酸比醇易电离出氢离子,则金属Na在B中的反应速率比在D中快,故D正确;
故答案为:BD.
点评 本题考查有机物的推断,为高频考点,把握A为乙烯、C为乙醛为有机物推断的关键,侧重分析与推断能力的考查,注意有机物性质的应用,D为推断的难点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题

 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| B. | 金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | FeCl2溶液和Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
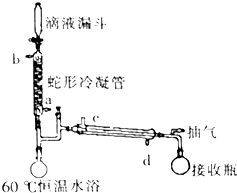 过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下:
过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下: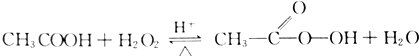 ,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.
,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应过程中消耗1mol氯气,则1mol<转移电子数<$\frac{5}{3}$mol | |
| B. | 反应停止后n(NaClO):n(NaCl):n(NaClO3)(物质的量之比)可能为1:11:2 | |
| C. | 反应过程中消耗氯气与NaOH的物质的量之比为1:2 | |
| D. | 氧化产物为NaClO和NaClO3,反应过程中n(NaClO):(NaClO3)为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com