
X、Y、Z、M、N分别是常见的酸、碱、盐中的某种物质,已知X是含钠元素的化合物它们之间有以下反应关系:
①2X+Y=Z+2H2O ②Z+M=BaSO4↓+2X ③M+CuSO4=BaSO4↓+N
根据上述反应
(1)推断各物质的化学式为:X________ Y_______ Z________ M________ N________
(2)完成上述反应的离子方程式:①________ ②________ ③________
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
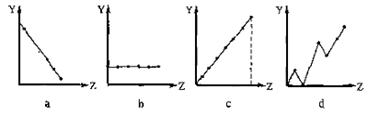
(13分) (1)(3分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的最外层电子数 ▲ 。 ②第3周期元素的最高化合价 ▲ 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 ▲ 。
(2)(10分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子
最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为
3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是 ▲ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离,B能促
进水的电离,则化合物A的化学式为 ▲ ,B的化学式是 ▲ 。
③Z与Y形成的稳定化合物的电子式为 ▲ 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式: ▲
该反应中转移的电子数目为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市六校高三12月联考化学试卷(解析版) 题型:填空题
X、Y、Z、M、N是五种短周期元素,原子序数依次增大。X原子中没有中子,Y元素最高正价与最低负价之和为0;M与X同主族;Z、N分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) ,M离子的电子排布式为 。
由以上某些元素组成的化合物A、B、C、D有如下转化关系

其中C是溶于水显酸性的气体;D是淡黄色固体。
(3)写出C的结构式 ;D的电子式
(4)如果A、B均由三种元素组成,B为两性不溶物,写出由A转化为B的离子方程式
(5)如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因 。
(6)如果将27题中A、B浓度均为0.1mol/L的溶液混合,混合溶液中离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市石景山区高三上学期期末考试化学试卷 题型:填空题
(18分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
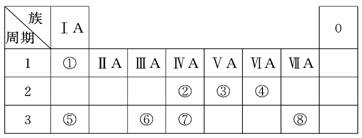
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
__________,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式_______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)________。
a.MnO2 b. CuSO4 c.Na2SO3 d.FeCl3
(5) W与④是相邻的同主族元素。在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式。
|
编号 |
性质 |
化学方程式 |
|
示例 |
氧化性 |
H2WO3+3H3PO3===3H3PO4+H2W↑ |
|
1 |
|
|
|
2 |
|
|
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式______________,
N→⑥的单质的化学方程式为____________,
M溶液中离子浓度由大到小的排列顺序是______________ ,
M中阳离子的鉴定方法 __________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com