
【题目】常温下,关于等体积、等pH的稀盐酸和稀醋酸溶液,下列说法正确的是
A.两溶液中由水电离的![]() :盐酸>醋酸
:盐酸>醋酸
B.两溶液中![]()
C.分别与足量的金属锌反应生成氢气的量:盐酸>醋酸
D.分别用水稀释相同倍数后溶液的pH:盐酸=醋酸
【答案】B
【解析】
醋酸是弱酸,水溶液中存在电离平衡。重视外因对电离平衡的影响。
A. 稀盐酸和稀醋酸溶液中的OH-均来自水的电离,两溶液pH相等,则H+、OH-浓度分别相等,即水电离的![]() :盐酸=醋酸,A项错误;
:盐酸=醋酸,A项错误;
B. 两溶液分别满足电荷守恒关系c(H+)=c(OH-)+c(Cl-)、c(H+)=c(OH-)+c(CH3COO-),两溶液的pH相等,c(H+)和 c(OH-)的也相等,则c(Cl-)=c(CH3COO-),B项正确;
C. 稀盐酸和稀醋酸等体积、等pH,则H+等物质的量,与足量的金属锌反应时促进醋酸电离出更多H+,生成更多氢气,故生成氢气量:盐酸<醋酸,C项错误;
D. 稀释过程中,醋酸电离平衡右移。分别用水稀释相同倍数后,醋酸溶液中H+浓度较大,pH较小,则溶液的pH:盐酸>醋酸,D项错误。
本题选B。


科目:高中化学 来源: 题型:
【题目】对可逆反应A(g)+B(g)![]() 2C(g)+D(s)△H>0,向1L绝热容器中加入1molA和1molB发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
2C(g)+D(s)△H>0,向1L绝热容器中加入1molA和1molB发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
①单位时间内消耗amolA,同时生成2amolC
②混合气体的总压强不再变化
③混合气体的密度不再变化
④A、B、C的分子数之比为1∶1∶2
⑤反应容器中温度不变
⑥A的转化率与B的转化率相等时
A. ①②④⑥ B. ②④⑥ C. ①④⑥ D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]在一定条件下的转化如图所示,下列说法正确的是( )

A. a、b、c、d符合关系式:a+b=c+d
B. X可能为NaOH
C. Q可能为NH3
D. 工业上用CO还原Al2O3的方法制取金属Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL![]()
![]() 溶液中逐滴加入20mL
溶液中逐滴加入20mL![]() 的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
的盐酸,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是
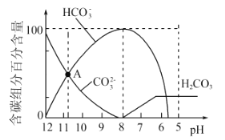
A.HCl溶液滴加一半时:![]()
B.在A点:![]()
C.当![]() 时:
时:![]()
D.当![]() 时,溶液中
时,溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物B是芳香烃的含氧衍生物,其相对分子质量不超过120,B中含氧的质量分数为14.8%,B与NaOH溶液不发生反应。有机物A在一定条件下可发生反应A+H2O![]() B+C。有关C的转化关系如下图所示:
B+C。有关C的转化关系如下图所示:
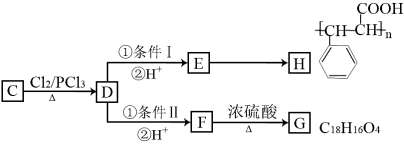
已知:![]()
根据以上信息,回答下列问题:
(1)B的结构简式为 ,条件I、II中均需要的试剂为 。
(2)有关C的转化关系图中所发生的反应中属于取代反应的有 个。
(3)C的同分异构体中,同时符合下列要求的物质有 种。
a.苯环上有两个侧链 b.能发生银镜反应 c.能发生消去反应
(4)写出G→F转化的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是( )
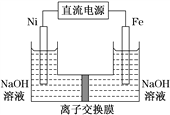
A. 铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2
B. 电解一段时间后,镍电极附近溶液的c(OH-)减小
C. 若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO![]()
D. 每制得1 mol Na2FeO4,理论上可以产生67.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(Ⅱ)酸钾晶体![]() (其摩尔质量为354g·
(其摩尔质量为354g·![]() ),是一种工业用化工原料。微溶于冷水,微溶于酒精,虽可溶于热水但会慢慢分解,干燥时较为稳定,温度高于260℃易分解。现以胆矾和草酸钾晶体为原料制备二草酸合铜(Ⅱ)酸钾晶体流程如下:
),是一种工业用化工原料。微溶于冷水,微溶于酒精,虽可溶于热水但会慢慢分解,干燥时较为稳定,温度高于260℃易分解。现以胆矾和草酸钾晶体为原料制备二草酸合铜(Ⅱ)酸钾晶体流程如下:

根据以上内容请回答:
(1)冷却混合液时___________(“能”或者“不能”)用冰水加速冷却,原因是_________________
(2)下列说法正确的是_____________。
a.抽滤时选用的滤纸要小于布氏漏斗内径。且能盖住所有小孔
b.洗涤时可用冷水作洗涤剂
c.洗涤固体时,应开大水龙头,使洗涤过程快速完成
d.可以用加热烘干固体法,但加热温度不宜很高
(3)胆矾晶体可以从硫酸铜溶液中获得。具体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.___________________。
②在蒸发浓缩的初始阶段可通过_________(填操作名称)回收乙醇。
(4)准确称取制取的试样1.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入10mL3.000![]() 的
的![]() 溶液,用0.01000
溶液,用0.01000![]() 的
的![]() 溶液滴定,消耗
溶液滴定,消耗![]() 标准液18.00mL,则该产品的纯度是_____________。
标准液18.00mL,则该产品的纯度是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气态烃A在一定条件下和B发生下列反应生成物质C,已知烃A在标准状况下的密度为1.16gL-1。

请回答:
(1)A的官能团名称为______________。
(2)上述有机反应类型为____________。
(3)下列说法正确的是________
a.C的密度比水大
b.A、B、C都能与溴水反应
c.C分子中所有碳原子处于同一个平面
d.C分子的一氯代物有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,青蒿素是一种无色针状晶体,易溶于有机溶剂,难溶于水,熔点约为156.5℃,易受湿、热的影响而分解。某实验小组对青蒿素的提取和组成进行了探究。
Ⅰ.提取流程:

⑴ “破碎”的目的是_______________________________________。
⑵ 操作a和操作b的名称分别是_________、___________。
⑶ 操作a用到的玻璃仪器有玻璃棒、_____________________。
⑷ 操作a所用青蒿必须干燥且不宜加热,原因是_______________________________。
Ⅱ.燃烧法测定最简式:
实验室用下图所示装置测定青蒿素(烃的含氧衍生物)中氧元素的质量分数。

⑸ 实验前至少称量_________个质量数据。
⑹ 装置D中所盛固体可以是____(用对应符号填空);(a.生石灰 b.CaCl2 c.CuSO4 d.碱石灰)
F的作用是_______________________________________。
⑺ A中固体分别用MnO2、KMnO4时产生等量O2,消耗H2O2的物质的量之比为______。(生成的O2全部放出,与KMnO4反应的H2O2经过酸化)
⑻ 燃烧m g青蒿素,图中D、E的质量分别增重a g、b g,则青蒿素中氧元素的质量分数可表示为_________________(只写计算式,用含有m、a、b的符号来表示,不化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com