
| A. | 氯化铝 | B. | 碳酸氢钠 | C. | 高锰酸钾 | D. | 硫酸钠 |
分析 物质的溶液在蒸发皿中加热蒸干并灼烧,最后得到该物质固体,如果是盐,说明该物质为难挥发性酸的盐,且该盐较稳定,受热不易发生反应,据此分析解答.
解答 解:A、氯化铝易水解生成氢氧化铝和HCl,升高温度HCl易挥发,蒸干溶液得到的固体是氢氧化铝,灼烧氢氧化铝,氢氧化铝分解生成氧化铝,所以最终得到的固体是氧化铝,故A错误;
B、蒸干后碳酸氢钠会受热分解,得碳酸钠固体,故B错误;
C、高锰酸钾溶液蒸干后再加热,高锰酸钾会受热分解为锰酸钾、二氧化锰和氧气,故最终得到的固体为锰酸钾和二氧化锰,故C错误;
D、硫酸钠溶液蒸干时不水解或分解或被氧化变质,故蒸干并加热后得硫酸钠,故D正确.
故选D.
点评 本题考查盐类水解的应用,侧重考查物质性质,加热蒸干灼烧易挥发性酸的盐最终得到的物质是金属氧化物,加热蒸干灼烧难挥发性酸的盐且该盐不易发生反应时得到其物质本身.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
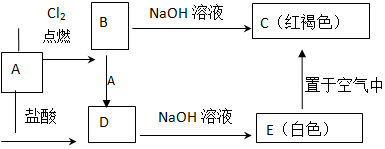
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2↑ | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | 2NaC12$\frac{\underline{\;电解\;}}{\;}$2Na+C12↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精炼时粗铜接电源负极 | |
| B. | 精炼时纯铜作阴极 | |
| C. | 杂质都将以单质形式沉积到池底 | |
| D. | 纯铜片增重2.56 g,电路中通过电子为0.04 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、OH-、SO42- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | K+、H+、SO42-、Al3+ | D. | Na+、H+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 同一元素的各种同位素的物理性质、化学性质均相同 | |
| D. | 除氦外的稀有气体原子的最外层电子数都是8 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A-F是中学化学中常见的物质,其中A、C、E、F为气体,B、D为液体,D是中学常见的强酸,D的浓溶液与铜共热可生成A:F的浓度液与X共热通常用于中学实验室制备单质C:B和X混合是实验室常温下简易制单质E的一种方法,X是一种黑色粉末,B的分子中有18个电子.反应中部分生成物略去,试回答下列问题:
已知A-F是中学化学中常见的物质,其中A、C、E、F为气体,B、D为液体,D是中学常见的强酸,D的浓溶液与铜共热可生成A:F的浓度液与X共热通常用于中学实验室制备单质C:B和X混合是实验室常温下简易制单质E的一种方法,X是一种黑色粉末,B的分子中有18个电子.反应中部分生成物略去,试回答下列问题: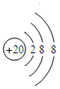 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com