
由C、N、O、Cl四种元素组成的化合物的分子式可表示为CxNyOzCln,经测定分子中所有原子均满足最外层8电子结构,下列说法中正确的是:
A、x为奇数时,n一定为奇数
B、y为奇数时,n一定为奇数
C、z为奇数时,n一定为奇数
D、x、y、z、n均只能为偶数
科目:高中化学 来源: 题型:
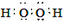
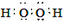
查看答案和解析>>
科目:高中化学 来源: 题型:
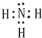
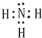
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| ||
| 8d3 |
| ||
| 8d3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(4分)在探索生命奥秘的过程中,生物学家和化学家都做出了杰出的贡献。科学家们发现人体细胞中的大量元素有C、H、O、N、P、S、Ca、K、Na、Cl、Mg等11种,它们全部位于元素周期表中前20号元素之内,其他多种微量元素如Fe、Zn、Cu、Mn、Mo、I、Se等也大多数位于第四周期。
2-1 在上述元素中,人体蛋白质是由________等元素组成,核酸则是由______等元素组成。
2-2 科学家利用返回式航天器从某个小行星上收集回一些物质样本,经过仪器分析,这些物质中的主要元素组成及含量如下:
元素 | C | H | O | N | P | S | Fe | Si | Al |
质量% | 0.01 | 0.3 | 0.9 | 0.11 | 0.03 | 0.6 | 95.1 | 1.5 | 0.5 |
请根据上面内容判断,该物质是不是小行星上的生物体的组成物质?请说明理由。
___________________________________________________________________________
___________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com