
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
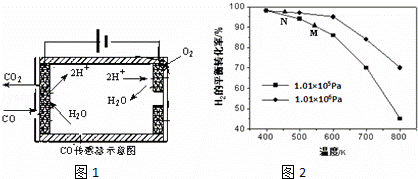
(1)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气.
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ/mol
CO(g)+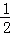 O2(g)=CO2(g)△H2=﹣283kJ/mol
O2(g)=CO2(g)△H2=﹣283kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g)△H3则△H3= kJ•mol﹣1.
(2)气缸中生成NO的反应为:N2(g)+O2(g)═2NO(g)△H>0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 .
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡,测得NO为8×10﹣4mol.计算该温度下的平衡常数K≈ .
(3)尾气中的CO主要来自于汽油不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)△H=+221kJ•mol﹣1,简述该设想能否实现的依据:
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用如图1简单表示,则阳极发生的电极反应为 .
(4)汽车尾气中的CO可转化为甲烷,方程式为CO(g)+3H2(g)⇌CH4(g)+H2O(g).其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图2所示.
①该反应的△H 0(填“<”、“=”或“>”).
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由 .
| 热化学方程式;化学平衡的影响因素;化学平衡的计算. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,得到反应焓变; (2)①依据影响化学反应速率和化学平衡的因素分析判断; ②结合化学三段式列式计算平衡浓度,平衡常数等于生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积计算; (3)①依据反应自发进行的条件是△H﹣T△S<0分析判断; ②依据电解原理分析,阳极是失电子发生氧化反应的物质,结合图示可知是一氧化碳失电子生成二氧化碳; (4)①由图可知,压强一定时,升高温度,平衡时氢气的转化率降低,平衡向逆反应方向移动,正反应为放热反应; ②相对于N点而言,采用M点,温度在500﹣600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高; |
| 解答: | 解:(1)①N2(g)+O2(g)═2NO(g)△H1=+180kJ/mol ②CO(g)+ 依据盖斯定律计算②×2﹣①得到:2NO(g)+2CO(g)═2CO2(g)+N2(g)△H3 =﹣746KJ/mol; 故答案为:﹣746; (2)①N2(g)+O2(g)═2NO(g)△H>0,反应时气体体积不变的吸热反应,温度升高,反应速率加快,平衡右移,单位时间内NO排放量越大; 故答案为:温度升高,反应速率加快,平衡右移; ②1mol空气中含有0.8mol N2和0.2mol O2,1300℃时在含1mol空气的密闭容器内反应达到平衡.测得NO为8×10﹣4mol. N2(g)+O2(g)═2NO(g) 起始量(mol) 0.8 0.2 0 变化量(mol) 4×10﹣4 4×10﹣4 8×10﹣4 平衡量(mol) 0.8﹣4×10﹣4 0.2﹣4×10﹣4 8×10﹣4 反应前后气体物质的量不变,用气体物质的量代替平衡浓度计算平衡常数K= 故答案为:4×10﹣6; (3)①2CO(g)═2C(s)+O2(g)△H=+221kJ•mol﹣1,反应是焓变增大,熵变减小的反应,△H>0,△S<0,则△H﹣T△S>0,反应任何温度下都不能自发进行; 故答案为:该反应是焓增、熵减的反应,任何温度下均不能自发进行; ②阳极是失电子发生氧化反应的物质,结合图示可知是一氧化碳失电子生成二氧化碳同时生成氢离子,电极反应为:CO+H2O﹣2e﹣=CO2+2H+; 故答案为:CO+H2O﹣2e﹣=CO2+2H+; (4)①由图可知,压强一定时,升高温度,平衡时氢气的转化率降低,平衡向逆反应方向移动,正反应为放热反应,故△H<0,故答案为:<; ②相对于N点而言,采用M点,温度在500﹣600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高, 故答案为:相对于N点而言,采用M点,温度在500﹣600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高; |
| 点评: | 本题考查热化学方程式书写、化学平衡影响因素、平衡常数计算等,注意利用三段式计算,难度中等. |


科目:高中化学 来源: 题型:
在体积可变的容器中发生反应N2+3H2⇌NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
|
| A. | 分子运动速率加快,使反应物分子间的碰撞机会增多 |
|
| B. | 反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
|
| C. | 活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多 |
|
| D. | 分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞 |
|
| D. | 分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献.
①氟化氢(HF)的水溶液能雕刻玻璃.制备普通玻璃的主要原料有SiO2、CaCO3、 (填化学式).
②水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g)═CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
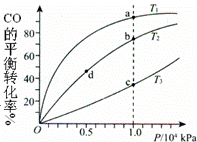
|
| A. | 温度:T1>T2>T3 |
|
| B. | 正反应速率:υ(a)>υ(c) υ(b)>υ(d) |
|
| C. | 平衡常数:K(a)>K(c) K(b)=K(d) |
|
| D. | 平均摩尔质量:M(a)<M(c) M(b)<M(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是( )
| 物质及其杂质 | 检验 | 除杂 | |
| A | Cl2(HCl) | 湿润的淀粉KI试纸 | 饱和食盐水 |
| B | NO(NO2) | 观察颜色或湿润的淀粉KI试纸 | 水 |
| C | CO2(HCl) | AgNO3溶液(含稀硝酸) | 饱和Na2CO3溶液 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 | 过量CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。

已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是 。
(2)吸收塔中的原料B可以选用 (填字母序号)。
A.NaCl溶液 B.Na2CO3溶液 C.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3 的过程(加热装置已略去)。
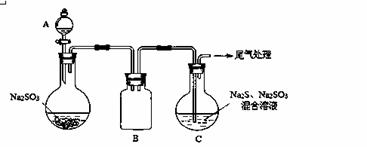
① A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是 。装置B的作用是 。
② C中制备Na2S2O3发生的连续反应有:Na2S + H2O + SO2 ===Na2SO3 +H2S、
和Na2SO3 + S  Na2S2O3 。
Na2S2O3 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列化学用语描述和理解都正确的是
原子结构示意图 ,可以表示
,可以表示 ,也表示
,也表示
B. 比例模型 可以表示水分子,也可以表示二氧化碳分子
可以表示水分子,也可以表示二氧化碳分子
C. 结构示意图为 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
D.电子式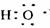 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是______________。试写出制备金属钠的化学方程式 。金属钠可用于 (写出Na在熔点低方面的一种用途)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:

①正极的电极反应式为________________,电池工作时物质A可循环使用,A物质的化学式为________________。
②请写出检验Na2CO3中钠元素的方法 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是 ,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______(填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为________________________。
②已知几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,________(填离子符号)先沉淀,Ksp[Fe(OH)2]______Ksp[Mg(OH)2](填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com