
·ÖĪö £Ø1£©¢Ł¼ĘĖć²Ī¼Ó·“Ó¦BµÄĪļÖŹµÄĮ棬ŌŁøł¾Ż·½³ĢŹ½¼ĘĖć²Ī¼Ó·“Ó¦AµÄĪļÖŹµÄĮ棬øł¾Żv=$\frac{\frac{”÷n}{V}}{”÷t}$¼ĘĖćv£ØA£©£»øł¾Żn=cV¼ĘĖćÉś³ÉCµÄĪļÖŹµÄĮ棬ĄūÓĆĪļÖŹµÄĮæÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č¼ĘĖćx£»
¢ŚĖę×Å·“Ó¦µÄ½ųŠŠ£¬·“Ó¦ĖŁĀŹÖš½„¼õŠ”£¬Čō·“Ó¦¾4min“ļµ½Ę½ŗā£¬ŗó2minµÄĘ½¾łĖŁĀŹŠ”ÓŚĒ°2minµÄĘ½¾łĖŁĀŹ£¬ŗó2minÄŚCµÄÅØ¶Č±ä»ÆŠ”ÓŚ0.4mol/L£»
¢ŪĘ½ŗā»ģŗĻĪļÖŠ£¬CµÄĢå»ż·ÖŹżĪŖ22%£¬Éč×Ŗ»ÆĮĖymolB£¬ĄūÓĆČż¶ĪŹ½±ķŹ¾³öĘ½ŗāŹ±ø÷×é·ÖµÄĪļÖŹµÄĮ棬ĄūÓĆCµÄĢå»ż·ÖŹżĮŠ·½³Ģ¼ĘĖćy£¬½ų¶ų¼ĘĖćBµÄ×Ŗ»ÆĀŹ£»
£Ø2£©¢ŁČōĪ¬³ÖČŻĘ÷Ń¹Ēæ²»±ä£¬ÅŠ¶ĻĢõ¼žĢå»ż±ä»Æ£¬µČŠ§ĪŖŃ¹Ēæ±ä»Æ£¬·ÖĪöĘ½ŗāŅĘ¶Æ·½Ļņ£»
¢ŚČōĪ¬³ÖČŻĘ÷Ń¹Ēæ²»±ä£¬øıäĘšŹ¼ĪļÖŹ¼ÓČėµÄĮ棬ÓūŹ¹·“Ó¦“ļµ½Ę½ŗāŹ±CµÄĪļÖŹµÄĮæŹĒŌĘ½ŗāµÄ2±¶£¬ÓėŌĘ½ŗāµČŠ§£¬·“Ó¦Īļ×Ŗ»ÆĀŹĻąµČ£¬Ó¦Āś×ćA”¢BµÄĪļÖŹµÄĮæÖ®±ČÓė³õŹ¼Åä±ČŹżĻąµČĒŅĪŖŌĄ“µÄ2±¶£®
½ā“š ½ā£ŗ£Ø1£©·“Ó¦2minŹ±²āµĆŹ£Óą0.6mol B£¬Ōņ²Ī¼Ó·“Ó¦µÄBĪŖ1mol-0.6mol=0.4mol£¬ÓÉ·½³ĢŹ½æÉÖŖ²Ī¼Ó·“Ó¦µÄAĪŖ0.4mol”Į3=1.2mol£¬¹Źv£ØA£©=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol/£ØL•min£©£¬
CµÄÅضČĪŖ0.4mol/L£¬ŌņÉś³ÉCµÄĪļÖŹµÄĮæ=2L”Į0.4mol/L=0.8mol£¬Ōņ0.4mol£ŗ0.8mol=1£ŗx£¬½āµĆ£ŗx=2£¬
¹Ź“š°øĪŖ£ŗ0.3mol/£ØL•min£©£»2£»
¢ŚĖę×Å·“Ó¦µÄ½ųŠŠ£¬·“Ó¦ĖŁĀŹÖš½„¼õŠ”£¬Čō·“Ó¦¾4min“ļµ½Ę½ŗā£¬ŗó2minµÄĘ½¾łĖŁĀŹŠ”ÓŚĒ°2minµÄĘ½¾łĖŁĀŹ£¬Ē°2minÄŚCµÄÅØ¶Č±ä»ÆĪŖ0.4mol/L£¬Ōņŗó2minÄŚCµÄÅØ¶Č±ä»ÆŠ”ÓŚ0.4mol/L£¬¹ŹĘ½ŗāŹ±CµÄÅØ¶ČŠ”ÓŚ0.8mol/L£¬
¹Ź“š°øĪŖ£ŗŠ”ÓŚ£»
¢ŪĘ½ŗā»ģŗĻĪļÖŠ£¬CµÄĢå»ż·ÖŹżĪŖ22%£¬Éč×Ŗ»ÆĮĖxmolB£¬ŌņÓŠ£ŗ
3A£Øg£©+B£Øg£©ØT2C£Øg£©
ĘšŹ¼£Ømol£©£ŗ3 1 0
×Ŗ»Æ£Ømol£©£ŗ3x x 2x
Ę½ŗā£Ømol£©£ŗ3-3x 1-x 2x
Ōņ£ŗ$\frac{2x}{3-3x+1-x2+x}$=22%£¬½āµĆ£ŗx=0.36£¬
ŌņBµÄ×Ŗ»ÆĀŹŹĒ£ŗ$\frac{0.36mol}{1mol}$”Į100%=18%£¬
¹Ź“š°øĪŖ£ŗ36%£»
£Ø2£©¢ŁČŻĘ÷Ģå»ż¹Ģ¶ØŹ±CµÄĢå»ż·ÖŹżĪŖ22%£¬ČōĪ¬³ÖČŻĘ÷Ń¹Ēæ²»±ä£¬Ó¦ĖõŠ”Ģå»ż£¬µČŠ§ĪŖŌö“óŃ¹Ēæ£¬Ę½ŗāĻņÕż·½ĻņŅĘ¶Æ£¬Ōņ“ļµ½Ę½ŗāŹ±CµÄĢå»ż·ÖŹż“óÓŚ22%£¬
¹Ź“š°øĪŖ£ŗ“óÓŚ£»
¢ŚČōĪ¬³ÖČŻĘ÷Ń¹Ēæ²»±ä£¬øıäĘšŹ¼ĪļÖŹ¼ÓČėµÄĮ棬ÓūŹ¹·“Ó¦“ļµ½Ę½ŗāŹ±CµÄĪļÖŹµÄĮæŹĒŌĘ½ŗāµÄ2±¶£¬ÓėŌĘ½ŗāµČŠ§£¬·“Ó¦Īļ×Ŗ»ÆĀŹĻąµČ£¬Ó¦Āś×ćA”¢BµÄĪļÖŹµÄĮæÖ®±ČÓė³õŹ¼Åä±ČŹżĻąµČĒŅĪŖŌĄ“µÄ2±¶£¬ŌņÓ¦¼ÓČė6molA£¬2molB£¬
¹Ź“š°øĪŖ£ŗ6£»2£®
µćĘĄ ±¾Ģā×ŪŗĻæ¼²é»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·»ÆŃ§Ę½ŗā¼°ĘäÓ°ĻģĪŖ½į¹¹¼ž£¬×¢ŅāĄūÓĆČż¶ĪŹ½·Ø½ā“šøĆĢā£¬ŅדķµćĪŖ£Ø2£©£¬×¢ŅāµČŠ§Ę½ŗāµÄĄķ½āŗĶÓ¦ÓĆ£¬ŹŌĢāÅąŃųĮĖѧɜµÄ»Æѧ¼ĘĖćÄÜĮ¦£®


 ŠĀæĪ±ź½×ĢŻŌĶĮѵĮ·ĻµĮŠ“š°ø
ŠĀæĪ±ź½×ĢŻŌĶĮѵĮ·ĻµĮŠ“š°ø æŚĖćŠÄĖćĖŁĖćÓ¦ÓĆĢāĻµĮŠ“š°ø
æŚĖćŠÄĖćĖŁĖćÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0 | B£® | +2 | C£® | +3 | D£® | +6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µČÓŚp% | B£® | “óÓŚp% | C£® | Š”ÓŚp | D£® | ĪŽ·ØÅŠ¶Ļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ĄūÓĆøŹÓĶĆܶȓóÓŚŅŅ“¼ĒŅøüŅ×ČÜÓŚĖ®£¬½ųŠŠøŹÓĶÓėŅŅ“¼µÄ»ģŗĻĪļ·ÖĄė | |
| B£® | 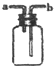 ½ųŠŠH2£¬NH3£¬CO2£¬Cl2£¬HCl£¬NO2µČĘųĢåŹÕ¼Æ£¬Ņ²ÄÜÓĆÓŚNOĘųĢåŹÕ¼Æ | |
| C£® |  µ±XŃ”ÓƱ½Ź±æɽųŠŠNH3ŗĶHClµÄĪüŹÕ£¬²¢·ĄÖ¹µ¹Īü | |
| D£® | 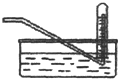 ³£ÓĆÓŚŹµŃéŹŅŹÕ¼ÆŃõĘų”¢ĒāĘųµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
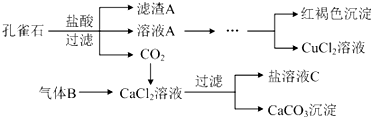
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | Ļ”ŹĶĒ°£¬ČÜŅŗpH£ŗ¢Ł£¾¢Ś=¢Ū | |
| B£® | Ļ”ŹĶŗó£¬ČÜŅŗpH£ŗ¢Ł£¾¢Ś=¢Ū | |
| C£® | Ļ”ŹĶĒ°£¬ČÜŅŗÖŠČÜÖŹµÄĪļÖŹµÄĮæÅØ¶Č£ŗ¢Ū£¾¢Ł=¢Ś | |
| D£® | Ļ”ŹĶŗó£¬ČÜŅŗÖŠČÜÖŹµÄĪļÖŹµÄĮæÅØ¶Č£ŗ¢Ū£¾¢Ł=¢Ś |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 ŹµŃéŹŅŠčŅŖ0.1mol/L NaOHČÜŅŗ450mL£¬ŠčŅŖ0.5mol/LĮņĖįČÜŅŗ500mL£®øł¾ŻÕāĮ½ÖÖČÜŅŗµÄÅäÖĆĒéæö»Ų“šĻĀĮŠĪŹĢā£ŗ
ŹµŃéŹŅŠčŅŖ0.1mol/L NaOHČÜŅŗ450mL£¬ŠčŅŖ0.5mol/LĮņĖįČÜŅŗ500mL£®øł¾ŻÕāĮ½ÖÖČÜŅŗµÄÅäÖĆĒéæö»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 25”ꏱ£¬pH=13µÄNaOHČÜŅŗÖŠŗ¬ÓŠOH-µÄŹżÄæĪŖ0.1NA | |
| B£® | ³£ĪĀĻĀ£¬21gC3H6ŗĶC4H8µÄ»ģŗĻĪļÖŠŗ¬ÓŠµÄĢ¼Ō×ÓŹżĪŖ1.5NA | |
| C£® | 46gŅŅ“¼ÖŠŗ¬ÓŠC-H¼üµÄŹżÄæĪŖ6NA | |
| D£® | ³£ĪĀĻĀ£¬2.7g½šŹōĀĮÓė×ćĮæÅضČĪŖ18mol/LµÄÅØĮņĖį·“Ó¦Ź±×ŖŅʵĵē×ÓŹżĪŖ0.3NA |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com