
【题目】某课题组以甲苯为主要原料,采用以下路线合成镇静催眠药物——苯巴比妥:
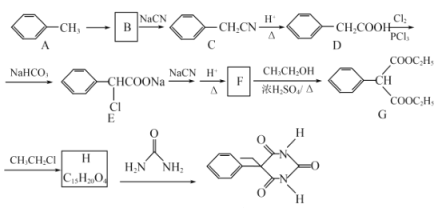
已知:![]() 。回答下列问题:
。回答下列问题:
(1)写出H的结构简式______________________。H→苯巴比妥的反应类型_________________。
(2)写出F→G的化学方程式________________________________。
(3)下列说法正确的是__________。
a.B的核磁共振氢谱有5组峰
b.化合物E能发生取代,氧化、加成、消去等反应
c.尿素在一定条件下可水解生成![]() 和
和![]()
d.苯巴比妥的分子式为![]()
(4)F制备G时会生成副产物![]() ,写出符合下列条件的M的同分异构体的结构简式: ___________________。
,写出符合下列条件的M的同分异构体的结构简式: ___________________。
①除苯环外不含其它环状结构。且苯环上有3个取代基;
②核磁共振氢谱图显示有5种化学环境不同的氢原子;
③该物质可发生银镜反应与水解反应,且1mol该物质完全水解时需要2molNaOH。
(5)以乙醇为原料可合成![]() ,请设计合成路线(用流程图表示,无机试剂任选)。___________
,请设计合成路线(用流程图表示,无机试剂任选)。___________
【答案】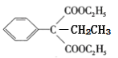 取代反应
取代反应 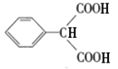 +2CH3CH2OH
+2CH3CH2OH![]() 2H2O+
2H2O+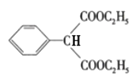 CD
CD 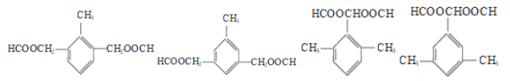 CH3CH2OH
CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]()
![]()
![]()
![]() HOOCCH2CH2COOH
HOOCCH2CH2COOH
【解析】
根据合成反应流程图,应用“已知”信息,紧扣反应条件、分子结构变化、分子组成变化等,进行推断验证,进而回答问题。
(1)由“G→H→苯巴比妥”,比较G、苯巴比妥结构,可知H中有-CH2CH3,且知-CH2CH3位置。H的结构简式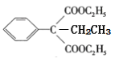 。H→苯巴比妥取代反应。
。H→苯巴比妥取代反应。
(2)流程图中,据“已知”和E结构可知F为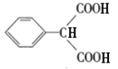 ,则F→G的化学方程式
,则F→G的化学方程式 +2CH3CH2OH
+2CH3CH2OH![]()
 +2H2O。
+2H2O。
(3)a.由A→B→C和“已知”可知B为![]() ,核磁共振氢谱有4组峰,a错误;
,核磁共振氢谱有4组峰,a错误;
b.化合物E![]() 分子中-Cl无βH,不能发生消去反应,b错误;
分子中-Cl无βH,不能发生消去反应,b错误;
c.一定条件下尿素[CO(NH2)2]分子中酰胺键可水解生成H2CO3和NH3,H2CO3分解生成H2O和![]() ,c正确;
,c正确;
d.苯巴比妥的分子式为![]() ,d正确。
,d正确。
正确的有cd。
(4)F制备G时生成的副产物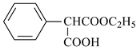 。①要求分子中有三价苯基
。①要求分子中有三价苯基![]() ;②要求分子有较好的对称性,三个取代基相同或二同一异,且相同取代基对称分布;③银镜反应需有醛基。1mol该物质完全水解时需要2molNaOH,须有两个醇酯基或1个酚酯基。通过试写、检验可得:
;②要求分子有较好的对称性,三个取代基相同或二同一异,且相同取代基对称分布;③银镜反应需有醛基。1mol该物质完全水解时需要2molNaOH,须有两个醇酯基或1个酚酯基。通过试写、检验可得: 。
。
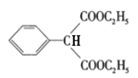
(5)乙醇分子中有2个碳原子,目标产物分子中有4个碳原子,利用“已知”反应可增加碳原子,即ClCH2CH2Cl+2NaCN→NCCH2CH2CN+2NaCl。乙醇(C2H5OH)经消去、加成可得ClCH2CH2Cl,由流程中“C→D”可将NCCH2CH2CN变成![]() 。故合成路线为:
。故合成路线为:
CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]()
![]()
![]()
![]() HOOCCH2CH2COOH。
HOOCCH2CH2COOH。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2气体和 SO3气体相比较,正确的说法是
A. 密度比为 4:5 B. 物质的量之比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 NaCl、Na2SO4 和 NaNO3 的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3 晶体,相应的实验流程如图所示。
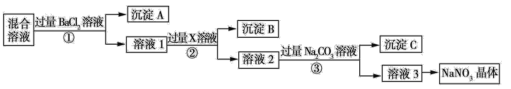
(1)写出实验流程中下列物质的化学式:试剂 X___________,沉淀 A_________。
(2)上述实验流程中①②③步均要进行的实验操作是______________(填操作名称),该过程中玻璃棒的作用是___________。
(3)上述实验流程中加入过量 Na2CO3 溶液的目的是_____________。
(4)按此实验方案得到的溶液3中肯定含有_________________(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的_________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
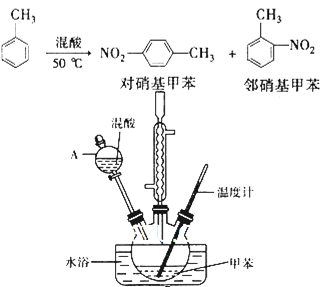
实验中可能用到的数据:
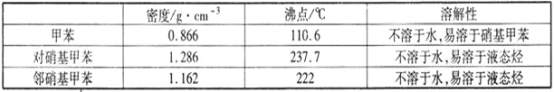
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是________。反应中需不断搅拌,目的是______________
(2)仪器A的名称是________ ,使用该仪器前必须进行的操作是_________。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为________,操作2中需要使用下列仪器中的________(填序号)。
A.冷凝管 B.酒精灯 C.温度计 D.分液漏斗 E.蒸发皿
(5)该实验中一硝基甲苯的产率为________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料。结合以下合成路线,回答下列问题。
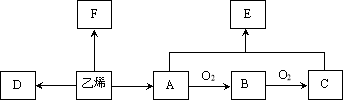
(1)乙烯的结构简式是______,A(乙醇)所含官能团的名称是__________。
(2)制备F(CH3-CH2Cl)有以下两种方案:
方案一 乙烷和氯气的取代反应 ;方案二 乙烯和氯化氢的加成反应
方案二优于方案一的原因是:_____________________________________ 。
(3)以乙烯为原料合成有机高分子化合物D(聚乙烯)的化学方程式为: 。
(4)以乙烯为原料可以合成一种有香味的物质E,实验室可通过下图所示装置来实现,请写出以下变化的化学方程式:
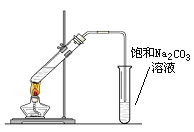
已知:B转化为C的化学方程式为:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
① A→B的化学方程: 。
② A+C→E的化学方程式: 。
(5)装置中导管末端不能插入饱和碳酸钠溶液中,是为了 。
(6)试管中饱和碳酸钠溶液的作用为:
(7)饱和碳酸钠溶液的试管中可看到的实验现象为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年7月5日《科学》杂志在线报道:合成一种新的具有超高热导率半导体材料——砷化硼(BAs)。通过反应4BI3(g) + As4(g)![]() 4BAs(s,晶体) + 6I2(g)可制备BAs晶体。下列说法错误的是()
4BAs(s,晶体) + 6I2(g)可制备BAs晶体。下列说法错误的是()
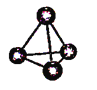
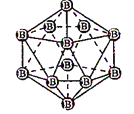
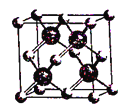
图(a) 图(b) 图(c)
A. 图(a)表示As4结构,As4分子中成键电子对与孤电子对数目之比为3:1
B. 图(b)表示晶态单质硼的B12基本结构单元,该基本单元为正20面体
C. 图(b)所示晶态单质硼的熔点为2180℃,它属于原子晶体
D. 图(c)表示BAs晶胞结构,As原子的配位数为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Si金属间化合物是近几年研究的热点材料,它在电子学、热电、光电和磁学等领域有着广泛的应用,另外铁的配合物也有极其广泛的用途。回答下列问题:
(1)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,其中Htrz为1,2,4–三氮唑(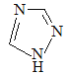 )。
)。
①配合物中阴离子空间构型为________,中心原子的杂化方式是________。
②Htrz分子中含σ键数为______个,其与Fe2+形成配位键的原子是_______。
③1,2,4–三氮唑与环戊二烯(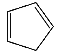 )的物理性质如下:
)的物理性质如下:
环戊二烯 | 1,2,4–三氮唑 | |
相对分子质量 | 66 | 69 |
物理性质 | 无色液体,不溶于水,沸点为42.5℃ | 无色晶体,溶于水,沸点为260℃ |
它们的水溶性和沸点差异很大的主要原因是________________________。
(2)一种Fe、Si金属间化合物的晶胞结构如下图所示:

晶胞中含铁原子为_____个,已知晶胞参数为0.564nm,阿伏加德罗常数的值为NA,则Fe、Si金属间化合物的密度为___________g·cm–3(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 溶液滴定
溶液滴定![]() 溶液,曲线如图所示。下列说法错误的是
溶液,曲线如图所示。下列说法错误的是
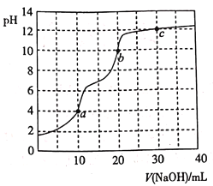
A.滴定终点a可选择甲基橙作指示剂
B.c点溶液中![]()
C.b点溶液中![]()
D.a、b、c三点中水的电离程度最大的是c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约10%,其余为空气),实验装置如图所示:
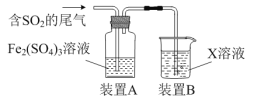
(1)装置A中SO2与Fe2(SO4)3溶液中反应生成FeSO4,写出该反应的化学方程式:___。
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为___;若要检验SO2是否过量,可用试剂为___。
(3)装置B中所用X溶液为___,作用是___。
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00mL装置A中溶液,向其中逐滴加入0.1000mol·L-1Ce(SO4)2溶液,发生反应Fe2++Ce4+=Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00mL。请通过计算确定FeSO4的物质的量浓度___(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com