
| 煅烧还原 |
| 水浸取 |
| 过滤 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:阅读理解
| 煅烧还原 |
| 水浸取 |
| 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
锌钡白是一种白色颜料,其主要成分是难溶于水的锌盐和钡盐,它们是
A.ZnCO3和BaCl2
B.ZnCl2和BaCO3
C.ZnS和BaSO4
D.ZnCO3和Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源:广东省广州市番禺区2010届高三第四次统测理综化学试题 题型:填空题
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4 = ZnS↓+BaSO4↓。以下是工业生产流程。请回答有关问题:
Ⅰ.ZnSO4溶液的制备与提纯
有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
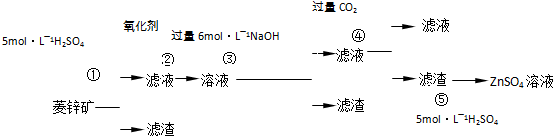
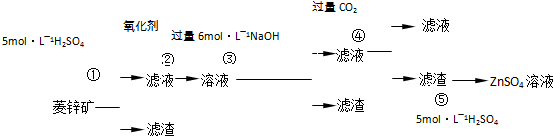
菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等。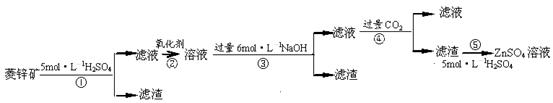 (1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
(1)②中使用的氧化剂最好是下列的 (填序号),理由是 。
| A.Cl2 | B.H2O2 | C.KMnO4 | D.浓HNO3 |
 有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ?mol-1
有关数据: Ba(s)+S(s)+2O2(g)=BaSO4(s);△H = —1473.2 kJ?mol-1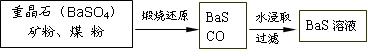
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省肇庆市高三级上学期末统一考试理综化学试卷(解析版) 题型:填空题
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4= ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
I.ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
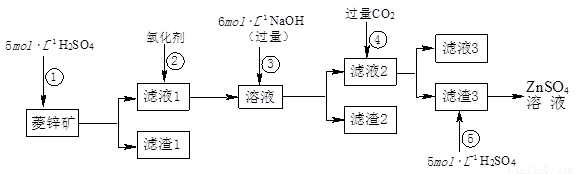
(1)滤渣1的化学式为 ;②中使用的氧化剂最好是下列的 (填序号)。
A.Cl2 B.H2O2 C.KMnO4 D.浓HNO3
(2)滤渣2中主要成分的化学式为 ;为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤 (选填①、②、③、⑤)。
(3)步骤④发生的离子反应方程式为 。
II.BaS溶液的制备
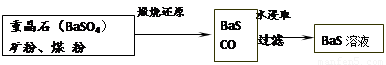
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H1 = -1473.2 kJ•mol-1
C(s)+ 1/2O2(g)=CO(g) △H2 = -110.5 kJ•mol-1
Ba(s)+ S(s)=BaS(s) △H3 = -460 kJ•mol-1
(4)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:
。
Ⅲ.制取锌钡白
(5)如果Ⅰ中步骤⑤使用硫酸过量,产生的后果是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com