
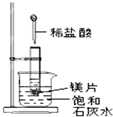
 如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题:分析 镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,反应物总能量高于生成物总能量的反应为放热反应,据此解答.
解答 解:①镁与盐酸反应生成氯化镁和氢气,离子方程式为:Mg+2H+=Mg2++H2↑;
故答案为:Mg+2H+=Mg2++H2↑;
②镁与盐酸反应生成氯化镁和氢气,该反应为放热反应,放出的热量使烧杯中饱和石灰水温度升高,氢氧化钙溶解度随着温度升高而降低,饱和石灰水中会有氢氧化钙沉淀析出,所以看到的现象为ⅠⅠ.镁片上有大量气泡产生;Ⅱ.镁片逐渐溶解;Ⅲ.烧杯中析出晶体;
故答案为:烧杯中析出晶体;镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体;
③反应物总能量高于生成物总能量的反应为放热反应,镁与盐酸反应产生氢气,该反应为放热反应所以MgCl2溶液和H2的总能量小于镁片和盐酸的总能量;
故答案为:小于.
点评 本题通过镁与盐酸的反应,考查了放热反应、氢氧化钙溶解度特点,题目难度不大,注意对基础知识的积累.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
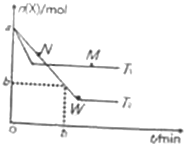 在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )| A. | 正反应方向为放热反应 | |
| B. | 在T2温度下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol•(L•min)-1 | |
| C. | M点的正反应速率v(正)大于N点的逆反应速率v(逆) | |
| D. | W点时再加入一定量X,平衡后X的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | B. | ${\;}_{19}^{40}$ K 和${\;}_{20}^{40}$ Ca | ||
| C. | O2 和 O3 | D. | H2O 和 D2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
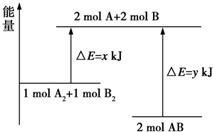
| A. | 该反应过程吸收能量 | |
| B. | 断裂 1molA-A 键和 1molB-B 键可放出 x kJ 能量 | |
| C. | 形成 2molA-B 键需要放出 y kJ 能量 | |
| D. | 2molAB 的总能量高于 1molA2和 1molB2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和S2O32-是氧化剂,Fe2+是还原剂 | |
| B. | 每生成1 mol Fe3O4,则转移电子数为2 mol | |
| C. | 参加反应的氧化剂与还原剂的物质的量之比为1:1 | |
| D. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
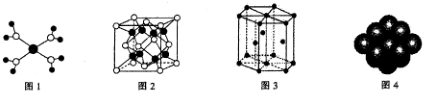
| A. | 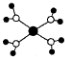 水合铜离子的模型如图所示,1个水合铜离子中含有4个配位键 | |
| B. | 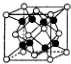 K2O晶体的晶胞如图所示,每个K2O晶胞平均占有8个O2- | |
| C. | 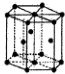 金属Zn中Zn原子堆积模型如图所示,空间利用率为68% | |
| D. |  金属Cu中Cu原子堆积模型如图,为面心立方最密堆积,每个Cu原子的配位数均为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com