
| A. | H、Be、B 原子最外层电子数依次增多 | |
| B. | P、S、Cl 元素最高正化合价依次升高 | |
| C. | F2、Cl2、Br2、I2的熔点依次降低 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
分析 A.H最外层含有1个电子,然后结合“同周期元素的原子从左到右最外层电子数依次增多”分析;
B.同周期元素从左到右电负性逐渐增强;
C.卤素单质的沸点从上到下逐渐升高;
D.同一主族元素,从上到下,第一电离能逐渐减小.
解答 解:A.H、Be、B原子最外层电子数分别为1、2、3,它们的原子最外层电子数依次增多,故A正确;
B.P、S、Cl元素最外层电子数分别为5、6、7,最高正价分别为+5、+6、+7,最高正价依次升高,故B正确;
C.随着原子序数的递增,卤素单质的沸点逐渐升高,则F2、Cl2、Br2、I2的熔点依次升高,故C错误;
D.同主族元素从上到下元素的金属性依次增强,则Li、Na、K、Rb元素的金属性依次增强,故D正确;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,明确元素周期律的内容为解答关键,试题有利于提高学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
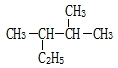 用系统命名法命名:2,3-二甲基丁烷
用系统命名法命名:2,3-二甲基丁烷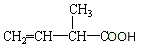 官能团的名称是碳碳双键、羧基
官能团的名称是碳碳双键、羧基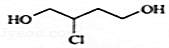 的分子式为C4H9O2Cl
的分子式为C4H9O2Cl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | I2>Br2>Cl2>F2 | ||
| C. | H2Te>H2Se>H2S>H2O | D. | 金刚石>CsCl>NaCl>钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3COH | B. | CH3OH | C. | CH3CHICH2CH3 | D. | (CH3)3C-CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
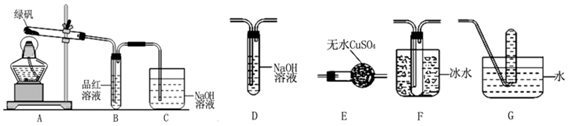
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com