
| A. | HCHO | B. | HCOOH | C. | HCOONa | D. | HCOOCH3 |
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
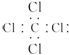
| A. | 全对 | B. | 全错 | C. | ③④ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何反应中的能量变化都表现为热量变化 | |
| B. | 任何化学反应都伴随着能量变化 | |
| C. | 反应物的总能量高于生成物的总能量,则反应释放能量 | |
| D. | 若化学键形成时释放的能量小于破坏旧化学键时所需要吸收的能量,则反应吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
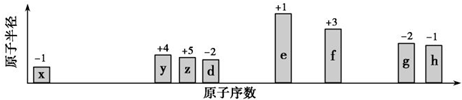
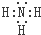 ;
;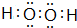 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入酸性高锰酸钾溶液;加稀硝酸酸化后加银氨溶液,微热 | |
| B. | 先加入溴水;加稀硝酸酸化后加酸性高锰酸钾溶液 | |
| C. | 先加入新制氢氧化铜悬浊液,加热;加稀硝酸酸化,再加入溴水 | |
| D. | 先加入银氨溶液;再另取该物质加入溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
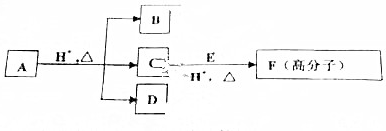
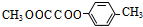 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
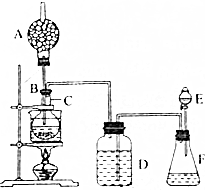
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
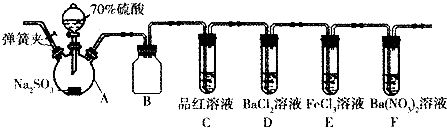
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com