
| A、c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) |
| B、c(Na+)>c(CO32->c(HCO3-)>c(OH-) |
| C、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-) |
| D、c(HCO3-)+c(CO32-)=0.1 mol?L-1 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
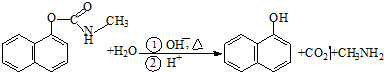
| A、西维因是一种芳香烃 |
| B、西维因分子中所有碳原子一定共面 |
| C、可用FeCl3溶液检验西维因是否发生水解 |
| D、在Ni催化下1mol西维因最多能与6molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| E |
| E |
| X |
| A、若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
| B、若D是一种强碱,则A、B、C均可与X反应生成D |
| C、若D为NaCl,且A可与C反应生成B,则E可能是CO2 |
| D、若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
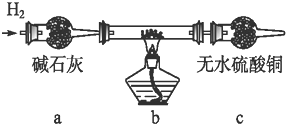 实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.
实验结束后,碳棒上的白色物质变为红色,无水硫酸铜不变色.查看答案和解析>>
科目:高中化学 来源: 题型:
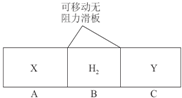 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C处分别充入等质量的X、H2、Y三种气体,当隔板静止时,A、C内的气体密度相等,下列说法正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在A、B、C处分别充入等质量的X、H2、Y三种气体,当隔板静止时,A、C内的气体密度相等,下列说法正确的是( )| A、X的相对分子质量等于Y的相对分子质量 |
| B、X的相对分子质量比Y的相对分子质量小 |
| C、气体的体积:V(X)>V(H2)>V(Y) |
| D、物质的量:n(X)<n(H2)<n(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温D23mtt1C23mt度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温D23mtt1C23mt度,y轴表示平衡混合气体中G的体积分数.据此可判断( )| A、上述反应是吸热反应 |
| B、上述反应是放热反应 |
| C、a>b |
| D、无法确定a、b的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com