
| A. | H2 | B. | CO | C. | CH4 | D. | 煤气(CO和H2) |
分析 根据H2、CO、CH4的相对分子质量分别为2、28、16,所以相同质量的这3种燃料的物质的量之比就是:$\frac{1}{2}$:$\frac{1}{28}$:$\frac{1}{16}$,再根据H2、CO、CH4是常用的燃料,它们每1 mol 分别完全燃烧生成H2O(l)及CO2(g)时,放出的热量依次为285.8 kJ、283.0 kJ、890.3 kJ计算相同质量燃烧放出热量之比,确定完全燃烧时放出热量最多.
解答 解:因为H2、CO、CH4的相对分子质量分别为2、28、16,所以相同质量的这3种燃料的物质的量之比就是:$\frac{1}{2}$:$\frac{1}{28}$:$\frac{1}{16}$,又H2、CO、CH4是常用的燃料,它们每1 mol 分别完全燃烧生成H2O(l)及CO2(g)时,放出的热量依次为285.8 kJ、283.0 kJ、890.3 kJ,所以相同质量燃烧放出热量之比为:($\frac{1}{2}$×285.8KJ):($\frac{1}{28}$×283.0kJ):($\frac{1}{16}$×890.3kJ)=142.9KJ:10.11KJ:55.64KJ,所以相同质量的H2、CO、CH4完全燃烧时,放出热量最多的是H2.
故选A.
点评 本题考查学生有关热化学方程式的计算知识,可以根据所学知识来回答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | “酸可除锈”、“洗涤剂可去油”都是发生了化学变化 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 油脂有油和脂肪之分,在酸性条件下水解生成高级脂肪酸和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、天然气 | B. | 铀和重水 | C. | 淡水 | D. | 钠、钾、镁、溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
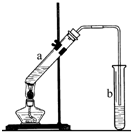 乙烯的产量可以用来衡量一个国家的石油化工发展水平,这是因为乙烯能够转化为许多重要的有机化工原料,例如:
乙烯的产量可以用来衡量一个国家的石油化工发展水平,这是因为乙烯能够转化为许多重要的有机化工原料,例如: 、
、 .
. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变某平衡体系的温度 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变压强 | |
| C. | 使平衡混合物中各组分的浓度发生变化 | |
| D. | 可逆反应达到平衡后,使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
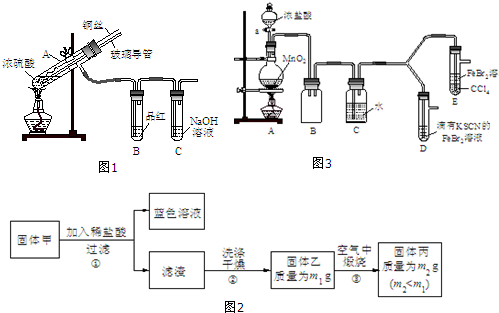
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
| ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应. ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com