
【题目】酸雨形成的原理之一可表示如下:
含硫燃料![]() A
A![]() B
B![]() 硫酸
硫酸
请回答下列问题。
(1)A的化学式为__________,B的化学式为__________________________________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)雨水的pH小于5.6时,就判定为酸雨。已知pH=-lgc(H+),经测定某次雨水所含酸性物质只有硫酸,且其浓度为5×10-5mol·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是__________(填字母)。
A.少用煤作燃料 B.把工厂的烟囱建高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________(填“可取”或“不可取”),理由是__________________________________________________。
【答案】SO2 SO3 ③ 还原剂 是 ACE 不可取 未减少二氧化硫的总排放量
【解析】
(1)含硫燃料在氧气中燃烧往往生成SO2,SO2经催化氧化生成SO3,SO3与水反应生成硫酸。
(2)从价态是否变化的角度分析判断。
(3)二氧化硫中硫的价态降低,需要加还原剂提供电子;
(4)先算H+浓度,再算pH,然后与5.6比较。
(5)建立“地球村”的理念,设法从根本上解决污染问题。
(1)含硫燃料燃烧往往生成SO2,二氧化硫在催化剂、加热条件与氧气反应生成SO3,所以A和B的化学式分别为SO2、SO3;
(2)所给的三个反应,前2个反应明显是氧化还原反应,第3个反应中元素的价态没有发生变化,属于非氧化还原反应;
(3) 此方案的目标是将二氧化硫中+4价的硫降为0价,所以需要外加还原剂来实现;
(4)硫酸的浓度为5×10-5mol·L-1,所以H+的浓度为10-4mol·L-1,该溶液的pH=-lgc(H+)=4,pH明显小于5.6,所以这次降雨属于酸雨;
(5)①燃煤中往往含有硫元素,少用煤作燃料或将燃煤进行脱硫处理,都可以较好地降低二氧化硫的排放量,从而减少硫酸型酸雨的产生。开发新能源可以更有效地减少酸雨的产生,答案选ACE;
②从全球环境保护的角度来看,建设烟囱的方法不可取。因为这种做法,实质上并未减少二氧化硫的总排放量,只是导致当地的二氧化硫的含量偏低,大量的二氧化硫随空气流动扩散到了别处。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.28g N2含有的原子数为NA
B.1mol Zn与足量盐酸反应失去的电子数为2NA
C.标准状况下22.4L水中含有的H2O分子数为NA
D.2mol /L NaCl溶液中含有Na+个数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。

已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:
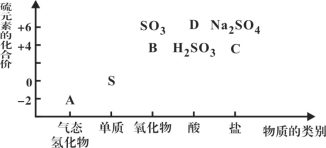
(1)图中A、B、C、D四种物质中,属于非电解质的是__________(用化学式表示)。
(2)足量B通入紫色石蕊试液的现象是______________________________________;
FeCl3溶液(酸性)中通入B的离子方程式为___________________________。
(3)C在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上其可被还原为____(填标号)。
A.Na2S B.S C.H2SO3 D.Na2SO4 E.H2SO4
(4)从硫元素化合价分析,硫单质具有氧化性和还原性。请举一例说明其具有氧化性(用化学方程式表示)_______________________________。
(5)将A与SO2混合,可生成淡黄色固体。该反应的氧化产物与还原产物的质量之比为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是

选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):

按下列要求写出:
(1)聚乙烯的结构简式是_____________,乙醛的结构简式是_____________;
(2)反应①的化学方程式是________________________________,反应类型是___________;
(3)反应③的化学方程式是________________________________,反应类型是___________;
(4)反应⑤的化学方程式是________________________________,反应类型是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:

①已知相关反应的能量变化如图所示:

过程Ⅰ的热化学方程式为________。
②关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
③其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是________。
(2)在一刚性密闭容器中,CH4和CO2的分压分别为20kPa、25kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
②达到平衡后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________(kPa)2。(用各物质的分压代替物质的量浓度计算)
(3)CH4超干重整CO2得到的CO经偶联反应可制得草酸(H2C2O4)。常温下,向某浓度的草酸溶液中加入一定浓度的NaOH溶液,所得溶液中![]() ,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
,则此时溶液的pH=________。(已知常温下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,

则如图操作应在下图中的________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |

(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是

A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com