
分析 物质的能量越低越稳定;利用盖斯定律①-②×4得:P4(s,白磷)=4P(s,红磷)据此计算出焓变△H,根据计算结果判断两种物质的稳定性.
解答 解:从题给热化学方程式可知,1mol白磷和4mol红磷质量相同,其在相同条件下燃烧时,1mol白磷放出2983.2KJ热量,而相同质量的红磷燃烧放出2954KJ的热量,可见红磷所具有的能量低,则红磷稳定;
已知:P4(s,白磷)+5O2(气体)=P4O10(固体)△H=-2983.2kJ•mol-1 ①
P(s,红磷)+$\frac{5}{4}$O2(气体)=$\frac{1}{4}$P4O10(固体)△H=-738.5kJ•mol-1 ②
据盖斯定律①-②×4得:P4(s,白磷)=4P(s,红磷)△H=-29.2KJ•mol-1,
故答案为:红磷;P4(s,白磷)=4P(s,红磷)△H=-29.2KJ•mol-1.
点评 本题考查了反应热与焓变的应用,题目难度不大,根据盖斯定律计算出白磷转化成红磷的热化学方程式为解答关键,注意掌握物质稳定性与具有能量的关系,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 食用醋中含有30%左右的乙酸 | |
| B. | 肥皂在碱性条件下水解可得甘油 | |
| C. | 为增加肥效,将草木灰与铵态氮肥混合施用 | |
| D. | 用pH试纸可检验食盐与假盐(NaNO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中只有离子,没有溶质分子 | |
| B. | 溶液中只有溶质分子,没有离子 | |
| C. | 在弱电解质的电离方程式中,可用“═”表示 | |
| D. | 溶液中分子和离子同时存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的H2和Cl2含有的分子数相等 | |
| B. | SO42-的摩尔质量是96 g•mol-1 | |
| C. | 阿伏加德罗常数恰好为6.02×1023mol-1 | |
| D. | 1 mol CO2的质量为44 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ②③ | C. | ①④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
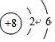 ;氮元素通常转化为化肥铵盐,铵根离子的电子式为
;氮元素通常转化为化肥铵盐,铵根离子的电子式为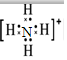 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13653I是碘的一种同素异形体 | |
| B. | 13653I是一种新发现的元素 | |
| C. | 它的中子数是53 | |
| D. | 核内的中子数与核外电子数之差为30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com