
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(己知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )
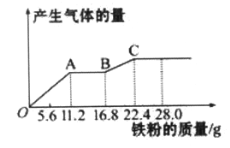
A. 第二份溶液中最终溶质为FeSO4
B. 原混合酸中NO3-物质的量为0.4mol
C. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
D. 取20 mL原混合酸加水稀释至1 L后溶液c(H+) =0.1mol L-l
【答案】B
【解析】
由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,A.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸;B、OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;C.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;D.最终溶液为硫酸亚铁,结合消耗铁的总质量计算硫酸的物质的量,进而计算硫酸的浓度。
A.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,选项A正确;B.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,由于原溶液分成2等份进行实验,故原混合液中n(NO3-)=2n(Fe)=2×![]() =0.2mol,选项B错误;C.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,选项C正确;D.第二份反应消耗22.4g铁,物质的量为
=0.2mol,选项B错误;C.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,选项C正确;D.第二份反应消耗22.4g铁,物质的量为![]() =0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.25mol,所原混合酸中H2SO4物质的量浓度为
=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.25mol,所原混合酸中H2SO4物质的量浓度为![]() =2.5mol/L,取20 mL原混合酸加水稀释至1 L后溶液c(H+) =2.5mol/L ×2×
=2.5mol/L,取20 mL原混合酸加水稀释至1 L后溶液c(H+) =2.5mol/L ×2×![]() 0.1mol L-l,选项D正确。答案选项B。
0.1mol L-l,选项D正确。答案选项B。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是 ( )
A. 2.24g B. 3.36g C. 5.60g D. 10.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机化合物,它们之间的转化关系如下图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基)。
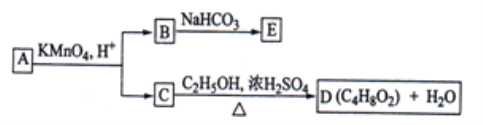
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为______;
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是_____________________,反应类型为______;
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是______;
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有______种,其相应的结构简式是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A. 硫酸、CuSO45H2O,苛性钾
B. 硫酸、空气、纯碱
C. 氧化铁、胆矾、熟石灰
D. 硝酸、食盐水、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:
阳离子 | K+、NH4+、Mg2+、Ba2+、 Fe3+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):

(1)由气体B可确定待测液中含有的离子是______________。
(2)由沉淀D和沉淀E可以判断待测液中一定含有______离子,据此可以排除的离子是________。
(3)由白色沉淀B可确定待测液中含有的离子是__________________。
(4)某同学读图后,认为待测液一定不含溴离子,他判断的依据是_________________。
(5)综合分析,待测液中K+的最小浓度为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com