
| A、H2与T2互为同位素 |
| B、氯化铵、氯化银都属于强电解质 |
| C、离子化合物中一定不含共价键 |
| D、SO2、CO均属于酸性氧化物 |


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
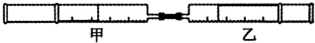
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 乙针筒里的现象 |
| A | HCl | AgNO3溶液 | 产生白色沉淀 |
| B | NH3 | FeCl3溶液 | 出现红褐色沉淀 |
| C | CO2 | BaCl2 | 产生白色沉淀 |
| D | Cl2 | 紫色石蕊溶液 | 先变红后褪色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y2-的离子半径大于W3+的离子半径 |
| B、Y、Z形成的化合物为离子化合物 |
| C、W的最高价氧化物对应的水化物的酸性比X的强 |
| D、Z的气态简单氢化物的稳定性比R的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4与稀硝酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O | ||||
| B、FeI2溶液中通入极少量Cl2:2I-+Cl2=I2+2Cl- | ||||
C、用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O
| ||||
| D、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Fe2++4I-+3Cl2→2Fe3++2I2+6Cl- |
| B、2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- |
| C、2Fe2++2I-+2Br-+3Cl2→2Fe3++I2+Br2+6Cl- |
| D、2Fe2++4I-+4Br-+5Cl2→2Fe3++2I2+2Br2+10Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
2 1 |
3 1 |
4 2 |
1 0 |
| A、D和T是质量数不同,质子数相同的氢的两种元素 | ||||||
B、通常所说的氢元素是指
| ||||||
C、
| ||||||
| D、这个反应既是核反应,也是化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、P4和NO2都是共价化合物 |
| B、浓硝酸能与木炭反应,证明浓硝酸既具有强氧化性又具有强酸性 |
| C、适量铜粉溶解于1L 0.5mol?L-1稀硝酸中,当生成2.24L NO时,溶液中氮原子数为0.4NA |
| D、若M=324g,N=288g,则合金至少消耗2mol/L的硝酸体积为6L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、由N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ?mol-1热化学方程式可知,当反应中转移6NA电子时,反应放出的热小于92.4 kJ |
| C、HCl和NaOH反应的中和热△H=-57.3 kJ?mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| D、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com