
【题目】我国成功研制出一种全新的铝-石墨双离子电池(AGDIB),这种新型AGDIB电池采用廉价且易得的石墨、铝箔作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。该电池工作原理是:充电过程中,石墨发生阴离子插层反应,而铝电极发生铝-锂合金化反应,放电过程则相反。电池反应式为CxPF6+ LiyAl![]() Cx+LiPF6+ Liy-1Al,下列说法不正确的是
Cx+LiPF6+ Liy-1Al,下列说法不正确的是

A.铝箔是电池负极
B.充电时,铝电极发生铝—锂合金化反应是还原反应
C.充电时A作阳极,放电时A电极的电极反应式为CxPF6+e-=Cx+![]()
D.废旧AGDIB电池进行“放电处理”,让Li+进入石墨中而有利于回收
【答案】D
【解析】
放电是原电池,根据装置图中根据离子转移方向或Li是活泼金属,即B电极为负极,A电极为正极,充电时,电池的正极接电源的正极,电池的负极接电源的负极,据此分析。
A. Li+从右向左移动,根据原电池工作原理,B电极为负极,A电极为正极,即铝箔是电池的负极,故A说法正确;
B. 电池充电时,电池的负极接电源的负极,电池的正极接电源的正极,根据A选项分析,铝电极在充电时作阴极,得电子,发生还原反应,故B说法正确;
C. 放电时,电极A为正极,根据电池反应式,该电极反应式为CxPF6+e-=Cx+PF6-,根据B选项分析,充电时电极A作阳极,故C说法正确;
D. 废旧AGDIR电池进行“放电处理”让Li+进入电解液中,不是进入石墨中,故D说法错误;
答案:D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有五种元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。![]() 元素为主族元素,
元素为主族元素,![]() 原子的
原子的![]() 层上有两个未成对电子且无空轨道;
层上有两个未成对电子且无空轨道;![]() 原子的价电子排布式为
原子的价电子排布式为![]() ;Z原子的
;Z原子的![]() 电子层的
电子层的![]() 亚层上有一个空轨道;
亚层上有一个空轨道;![]() 原子的
原子的![]() 电子层的
电子层的![]() 亚层上只有一对成对电子;
亚层上只有一对成对电子;![]() 原子的
原子的![]() 电子层上
电子层上![]() 轨道半充满。下列叙述不正确的是( )
轨道半充满。下列叙述不正确的是( )
A.元素![]() 和
和![]() 可形成化合物
可形成化合物![]()
B. ![]() 与
与![]() 的最高价氧化物对应的水化物,前者的酸性比后者强
的最高价氧化物对应的水化物,前者的酸性比后者强
C. ![]() 和
和![]() 结合生成的化合物为离子化合物
结合生成的化合物为离子化合物
D.![]() 是由极性键构成的非极性分子
是由极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2g碳与水蒸气完全反应生成水煤气时,吸收了13.16kJ热量。该反应的热化学方程式为___;该反应在条件下能自发进行___(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
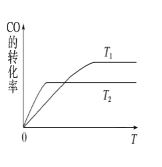
①T1___T2(填“>”、“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1___(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是___(填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是___;t3时采取的措施可能是___。
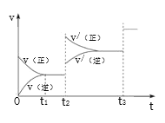
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=___(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铬具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,因而具有广泛应用前景。实验室制备CrN 反应原理为 CrCl3 +NH3![]() CrN+3HCl,装置如图所示
CrN+3HCl,装置如图所示

下列说法错误的是
A.装置①还可以用于制取O2、Cl2、CO2等气体
B.装置②、④中分别盛装NaOH溶液、KOH固体
C.装置③中也可盛装维生素c,其作用是除去氧气
D.装置⑤ 中产生的尾气冷却后用水吸收得到纯盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是
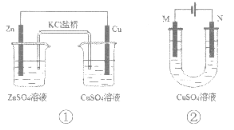
A. 装置①中,电子移动的路径是:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液
B. 在不改变总反应的前提下,装置①可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C. 装置②中采用石墨电极,通电后,由于OH-向阳极迁移,导致阳极附近pH升高
D. 若装置②用于铁棒镀铜,则N极为铁棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质G可做香料,其结构简式为![]() ,工业合成路线如下:
,工业合成路线如下:
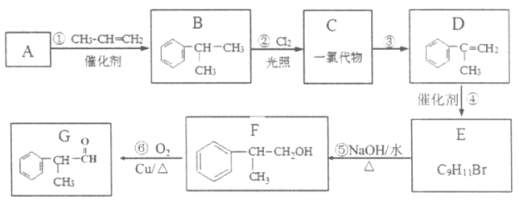
已知:
Ⅰ. 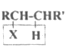
![]() RCH=CHR'
RCH=CHR'
Ⅱ.RCH2X+NaOH![]() RCH2OH+NaX
RCH2OH+NaX
(R、R'为烃基或H原子,X为卤素原子)
回答下列问题:
(1)A为芳香烃,相对分子质量为78。下列关于A的说法中,正确的是____(填序号)。
a.密度比水大
b.所有原子均在同一平面上
c.一氯代物只有一种
(2)反应①的反应类型为__________反应。
(3)C的核磁共振氢谱显示有4组峰,步骤②的化学方程式是__________。
(4)③的反应条件是__________。
(5)④为加成反应,E的核磁共振氢谱显示有6组峰,步骤④的化学方程式是_______。
(6)步骤⑤的化学方程式是__________。
(7)下列说法正确的是__________。
a.上述框图中方框内所有物质均为芳香族化合物
b.D存在顺反异构
c.反应②和⑤都是取代反应
(8)反应⑥中Cu是反应的催化剂,该反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学通过查阅资料获得两个信息:一是在CaO存在的条件下,干燥的NaOH与干燥的CH3COONa混合加热可得到CH4;二是在加热条件下CH4可还原CuO。他们设计如下装置(加热仪器省略)制备CH4、还原CuO并验证B中有CO2、H2O生成。
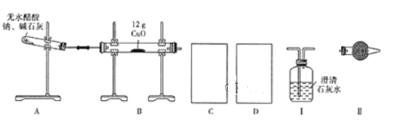
(1)为实现上述实验目的,C、D中的仪器应分别为_______________(填"Ⅰ、Ⅱ"或"Ⅱ、Ⅰ"),Ⅱ中的试剂是________________。
(2)A、B处均需要加热,实验中应先加热______处,表明B中有CO2生成的现象是_________。A中另一种生成物是常见的无机盐,A中反应的化学方程式为_________。
(3)实验表明,即使实验操作、使用试剂完全符合规范实验的要求,制备过程中试管仍会出现破裂情况,试分析其原因:________________。
(4)实验结束后,B中固体全部变成红色,甲同学通过查阅资料后认为,该固体可能是铜、氧化亚铜或者是二者的混合物,同时查得Cu2O在酸性条件下可转化为Cu、Cu2+。为确定红色固体的成分,他设计了如下两种方法。
①取少量红色固体于试管中,再向试管中加入足量的稀硫酸,判断含有Cu2O的现象是________,在常用的酸中,稀硫酸能不能换成稀硝酸_________(填“能”或“不能"),原因是_________。
②称量所得红色固体的质量,当固体质量(m)介于___________之间表明红色固体是Cu与Cu2O的混合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.6.0gSiO2晶体中含有共价键的数目为 0.2NA
B.标准状况下,22.4L甲醇中含有的 C-H 键数目为 0.3NA
C.室温下,53.5gNH4Cl晶体溶于氨水中,所得溶液 pH=7,NH![]() 的数目为NA
的数目为NA
D.用铅蓄电池电解氯化钠溶液,得到22.4L H2,铅蓄电池中消耗氢离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题:
A.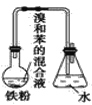 B.
B. 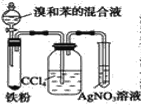 C.
C. 
(1)写出三个装置中所共同发生的主要反应的化学方程式:__________________。苯参与的反应的反应类型为________________
(2)装置 A 和 C 均采用了长玻璃导管,其作用是______________。
(3)在按装置 B 装好仪器及药品后要使反应开始,应对装置 B 进行的操作是_____________;分子式为 C8H10且属于苯的同系物的结构有_______________种。
(4)装置 B,C 较好地解决了 A 中加装药品和使装置及时密封的矛盾,方便了操作。A 装置中这一问题在实验中造成的后果是______________。
(5)B 中采用了洗气瓶吸收装置,其作用是_______________,反应后洗气瓶中可能出现的现象是_________________。
(6)B 装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com