
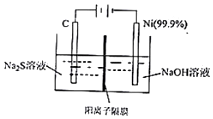
 现代煤化工产生的H2S是一种重要的工业资源.请回答:
现代煤化工产生的H2S是一种重要的工业资源.请回答:| 分子 | COS | H2 | H2O | CO | H2S | CO2 |
| 能量/KJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
分析 (1)用过量的NaOH吸收H2S,反应生成硫化钠和水;硫化钠为强碱弱酸盐,溶液中硫离子水解溶液显碱性;结合水解平衡常数表达式计算,S 2-+H2O?HS-+OH-,Kh=$\frac{c(O{H}^{-})c(H{S}^{-})}{c({S}^{2-})}$=$\frac{c(O{H}^{-})c(H{S}^{-})}{c({S}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{2}}$;
(2)电解时,阳极发生氧化反应,S2-失电子被氧化,阴极发生还原反应,H+得电子被还原生成氢气,结合电极方程式计算;
(3)反应热等于反应物的总键能减生成物的总键能,COS(g)+H2(g)?H2S(g)+CO(g)△H=+7KJ/mol,依据△H=反应物的总键能-生成物的总键能计算;
(4)反应①是吸热反应,反应②是放热反应,升温平衡向吸热反应方向进行;向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,
COS(g)+H2(g)?H2S(g)+CO(g)
起始量 2 2 0 0
变化量 0.4 0.4 0.4 0.4
平衡量 1.6 1.6 0.4 0.4
设反应②中水的转化率x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量 0.4 2 0 0
变化量 0.4x 0.4x 0.4x 0.4x
平衡量 0.4-0.4x 2-0.4x 0.4x 0.4x
反应前后气体物质的量不变,CO的体积分数为5%,$\frac{0.4-0.4x}{2+2+2}$=5%,
反应前后气体物质的量不变,则反应②平衡常数可以用气体物质的量计算;
解答 解:(1)用过量的NaOH吸收H2S,反应生成硫化钠和水,反应的离子方程式为:H2S+2OH-=S 2-+2H2O,硫化钠其溶液盛装在带橡胶塞的试剂瓶中,溶液呈碱性的原因为硫离子水解,离子方程式为:S 2-+H2O?HS-+OH-,水解平衡常数,Kh=$\frac{c(O{H}^{-})c(H{S}^{-})}{c({S}^{2-})}$=$\frac{c(O{H}^{-})c(H{S}^{-})}{c({S}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{2}}$,c(S2-)=1mol/L,则c(OH-)≈$\frac{Kw}{K{a}_{2}}$×c(S2-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$×1mol/L=10-2mol/L,c(H+)=10-12mol/L
PH=12
故答案为:H2S+2OH-=S 2-+2H2O; S 2-+H2O?HS-+OH-;12;
(2)电解时,阳极发生氧化反应,S2-失电子被氧化,阴极发生还原反应,H+得电子被还原生成氢气,电极方程式为2H++2e-=H2↑或2H2O+2e-=2OH-+H2↑,当反应转移n mol电子时,可生成0.5nmolH2,体积为0.5nmol×22.4L/mol=11.2nL,
故答案为:2H++2e-=H2↑或2H2O+2e-=2OH-+H2↑,11.2 n L;
(3)COS(g)+H2(g)?H2S(g)+CO(g)△H=+7KJ/mol,
△H=1323KJ/mol+436KJ/mol-678KJ/mol-XKJ/mol=7KJ/mol
X=1074
故答案为:1074;
(4)①COS(g)+H2(g)?H2S(g)+CO(g)△H=+7KJ/mol
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42KJ/mol
反应①吸热反应,升高温度,平衡正向动,CO的平衡体积分数增大,反应②是放热反应,升温平衡逆向进行,一氧化碳的平衡体积分数也增大,
向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,
COS(g)+H2(g)?H2S(g)+CO(g)
起始量 2 2 0 0
变化量 0.4 0.4 0.4 0.4
平衡量 1.6 1.6 0.4 0.4
设反应②中水的转化率x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量 0.4 2 0 0
变化量 0.4x 0.4x 0.4x 0.4x
平衡量 0.4-0.4x 2-0.4x 0.4x 0.4x
反应前后气体物质的量不变,CO的体积分数为5%,$\frac{0.4-0.4x}{2+2+2}$=5%,
反应前后气体物质的量不变,则反应②平衡常数可以用气体物质的量计算,K=$\frac{0.4×5%×0.4×5%}{(0.4-0.4×5%)×(2-0.4×5%)}$=0.30,
故答案为:反应①吸热反应,升高温度,平衡正向动,CO的平衡体积分数增大,反应②是放热反应,升温平衡逆向进行,一氧化碳的平衡体积分数也增大;5%;0.30;
点评 本题考查较为综合,涉及电解池以及含硫化合物的性质等知识,反应热的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握题给信息以及电极方程式的书写,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温下$\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:Ca2+、Fe2+、NO3-、NH4+ | |
| B. | 水电离出的c (H+)=10-10 mol•L-1的溶液中Na+、K+、Cl?、HCO3? | |
| C. | pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、Cl-、SO42-、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ③④⑥⑦ | C. | ③④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硝酸银溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| B | 向某溶液中滴加CCl4,振荡静置 | 下层溶液显紫色 | 原溶液中含有I- |
| C | 向25mL沸水中分别滴入5~6滴FeCl3饱和溶液,继续煮沸至出现红褐色沉淀,用激光笔照射 | 形成一条光亮通路 | 制得Fe(OH)3胶体 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液颜色变浅 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
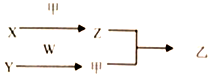 短周期元素A、B、C、D的原子序数依次增加.X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体.上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是( )
短周期元素A、B、C、D的原子序数依次增加.X、Y、Z、W分別是由这四种元素中的两种组成的常见化合物,甲为单质,乙为红棕色气体,Y为淡黄色固体.上述物质之间的转化关系如图所示(部分反应物或生成物省略),则下列说法中正确的是( )| A. | 原子半径:D>C>B>A | |
| B. | C、D的氢化物均为共价化合物 | |
| C. | 相对分子质量W>X,沸点W>X | |
| D. | B的氢化物常温下一定为气态,C的氢化物常温下为液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常采用电解法冶炼Z单质 | |
| B. | 气态氢化物的稳定性:H2X>H2M | |
| C. | 离子半径由大到小:M2->Y+>Z3+>X2- | |
| D. | X、Y形成的化合物中阳离子、阴离子个数比一定是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应不属于化学变化 | |
| B. | 112 号元素的相对原子质量为 227 | |
| C. | 科学家合成的 112 号元素的原子的中子数为 165 | |
| D. | 112 号元素属于第七周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3 四甲基丁烷 | B. | 2,3,4 三甲基戊烷 | ||
| C. | 3,3,4,4 四甲基己烷 | D. | 2,5 二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com