(2010?扬州模拟)实验室用共沉淀法制备纳米级Fe
3O
4的流程如下:
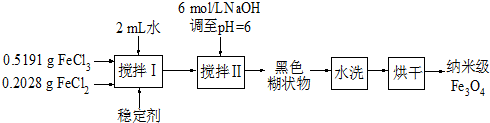
该方法的关键为促进晶粒形成,并控制晶体生长.试回答下列问题:
(1)该反应原理的离子方程式可表示为
Fe2++2Fe3++8OH-=Fe3O4+4H2O
Fe2++2Fe3++8OH-=Fe3O4+4H2O
.
(2)反应温度需控制在50℃,其方法是
水浴加热
水浴加热
,温度偏低造成产量低的可能是
温度低时反应缓慢
温度低时反应缓慢
.
(3)在搅拌Ⅱ的过程中还需加入10mL正丙醇,其作用是
降低Fe3O4的溶解度(使其易达到饱和,促进晶粒形成)
降低Fe3O4的溶解度(使其易达到饱和,促进晶粒形成)
.
(4)黑色糊状物转移至烧杯中,用倾析法洗涤,检验洗净的操作是
取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净.
取最后的倾出液,测其pH为中性(或滴加KSCN,不变血红色或加入经稀硝酸酸化的硝酸银溶液不产生沉淀),则已洗净.
.
(5)由上述分析可知,影响纳米级Fe
3O
4粒径大小的因素有(写出一条)
反应温度(或溶液的pH、稳定剂用量、铁盐的比例(浓度)、搅拌速度、溶剂的配比等)
反应温度(或溶液的pH、稳定剂用量、铁盐的比例(浓度)、搅拌速度、溶剂的配比等)
.




 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案