
| A. | Y的价层电子排布式为3s23p5 | |
| B. | 稳定性:Y的氢化物>Z的氢化物 | |
| C. | 第一电离能:Y<Z | |
| D. | X、Y两元素形成的化合物为离子化合物 |
分析 X、Y、Z为短周期元素,X原子最外层只有一个电子,则X为H、Li或Na;Y原子的最外层电子数比内层电子总数少4,则Y有3个电子层,最外层有6个电子,则Y为硫元素;Z的最外层电子数是内层电子总数的三倍,则Z有2个电子层,最外层电子数为6,则Z为氧元素,据此解答.
解答 解:X、Y、Z为短周期元素,X原子最外层只有一个电子,则X为H、Li或Na;Y原子的最外层电子数比内层电子总数少4,则Y有3个电子层,最外层有6个电子,则Y为硫元素;Z的最外层电子数是内层电子总数的三倍,则Z有2个电子层,最外层电子数为6,则Z为氧元素,
A.Y为硫元素,Y的价层电子排布式为3s23p4,故A错误;
B.Y为硫元素,Z为氧元素,非金属性O>S,非金属性越强,氢化物越稳定,氢化物稳定性Z>Y,故B错误;
C.Y为硫元素,Z为氧元素,第一电离能:Y<Z,故C正确;
D.X为H、Li或Na,Y为硫元素,H、Li或Na与硫元素可以形成硫化氢属于共价化合物,硫化钠和硫化锂属于离子化合物,故D错误;
故选C.
点评 本题以元素推断为载体,考查结构位置性质关系、元素化合物性质结构、元素周期律等,难度不大,注意基础知识的掌握.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:多选题
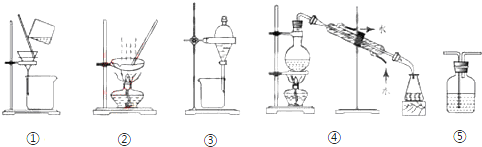
| A. | 分离Na2CO3溶液和CH3COOC2H5,选③ | B. | 用CCl4提取碘水中的碘,选② | ||
| C. | 实验室中蒸馏水的制取,选④ | D. | 粗盐提纯,选②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe2O3、Fe3O4、FeO | B. | FeO、Fe3O4 | C. | Fe3O4、Fe2O3 | D. | FeO、Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该实验需要用的主要玻璃仪器有:两个大小相同的烧杯、两只大小相同的量筒、温度计、环形玻璃搅拌棒 | |
| B. | 能用保温杯代替烧杯做有关测定中和热的实验 | |
| C. | 该实验至少需要测定并记录温度的次数是3次 | |
| D. | 若NaOH的物质的量稍大于HCl,会导致所测中和热数值偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com