
����Ŀ��ijͬѧ�������ʵ�鷽�����Է���NaCl��BaCl2���ֹ�������ش��������⣺

��ѡ�Լ���Na2CO3��Һ��Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ������
��1�������ڵ�������_____��
��2���Լ�a��____(�ѧʽ����ͬ)���Լ�b��___������B��____��
��3�������Լ�a��b�ֱ��������Ļ�ѧ��Ӧ����ʽΪ____��____��
��4���÷����ܷ�ﵽʵ��Ŀ��___�������ܣ�Ӧ��θĽ�(���ܣ����ʲ��ûش�)____��
���𰸡����� Na2CO3 HCl BaCl2 BaCl2+Na2CO3=BaCO3��+2NaCl BaCO3+2HCl=BaCl2+H2O+CO2�� ���� ����Һ�еμ�����ϡ������������ᾧ
��������
��������̿�֪���Ƚ�NaCl��BaCl2���ֹ�����������ˮ�����Һ��Ȼ��������Na2CO3��Һ��Na2CO3��Һ����Һ��BaCl2��Ӧ����̼�ᱵ�������Ȼ��ƣ����ˣ�������м������ᣬ������̼�ᱵ��Ӧ�����Ȼ�����������̼��ˮ������Ӧ���ɵ�BaCl2��Һ�������ᾧ������õ��Ȼ������壬������������ҺΪ�Ȼ��ƺ�̼���ƵĻ����Һ����������������ᾧ������õ��Ĺ���Ϊ�Ȼ��ƺ�̼���ƻ���
��1��������Ϊ���˷���̼�ᱵ�������Ȼ�����Һ���ʴ�Ϊ�����ˣ�
��2���Լ�a��Na2CO3��Һ������Na2CO3��Һ��Ŀ��������Һ��BaCl2��Ӧ����̼�ᱵ�������Ȼ��ƣ��Լ�b�����ᣬ���������Ŀ������̼�ᱵ��Ӧ�����Ȼ�����������̼��ˮ�õ��Ȼ�����Һ������Ӧ���ɵ�BaCl2��Һ�������ᾧ������õ��Ȼ������壬�����B���Ȼ������ʴ�Ϊ��Na2CO3��HCl��BaCl2��
��3���Լ�a��Na2CO3��Һ���������Na2CO3��Һ��Na2CO3��Һ����Һ��BaCl2��Ӧ����̼�ᱵ�������Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽΪBaCl2+Na2CO3=BaCO3��+2NaCl���Լ�b�����ᣬ�������ᣬ������̼�ᱵ��Ӧ�����Ȼ�����������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪBaCO3+2HCl=BaCl2+H2O+CO2�����ʴ�Ϊ��BaCl2+Na2CO3=BaCO3��+2NaCl��BaCO3+2HCl=BaCl2+H2O+CO2����
��4��������������ҺΪ�Ȼ��ƺ�̼���ƵĻ����Һ����������������ᾧ������õ��Ĺ���Ϊ�Ȼ��ƺ�̼���ƻ�����÷������ܴﵽʵ��Ŀ�ģ�Ӧ������Һ�м���������ᣬ��������Һ��̼������Һ��Ӧ�����Ȼ��ơ�������̼��ˮ������Ӧ���ɵ��Ȼ�����Һ�������ᾧ������õ��Ȼ��ƹ��壬�ʴ�Ϊ�����ܣ�����Һ�еμ�����ϡ������������ᾧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��COCl2(g)![]() CO(g)��Cl2(g)����H��0������Ӧ�ﵽƽ��ʱ�����д�ʩ�������¡��ں���ͨ��ϡ�����塡������COŨ�ȡ��ܼ�ѹ���ݼӴ�������ѹͨ��ϡ�����壬�����COCl2ת���ʵ���(����)
CO(g)��Cl2(g)����H��0������Ӧ�ﵽƽ��ʱ�����д�ʩ�������¡��ں���ͨ��ϡ�����塡������COŨ�ȡ��ܼ�ѹ���ݼӴ�������ѹͨ��ϡ�����壬�����COCl2ת���ʵ���(����)
A. �٢ڢ� B. �٢ܢ� C. �ڢۢ� D. �ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������,���ڿ��淴ӦX(g)+3Y(g)![]() 2Z(g),��X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��),�ﵽƽ��ʱ,X��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol��L-1��0.3 mol��L-1��0.08 mol��L-1,�������ж���ȷ����(����)
2Z(g),��X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3(����Ϊ��),�ﵽƽ��ʱ,X��Y��Z��Ũ�ȷֱ�Ϊ0.1 mol��L-1��0.3 mol��L-1��0.08 mol��L-1,�������ж���ȷ����(����)
A. c1��c2=3��1 B. ƽ��ʱ,Y��Z����������֮��Ϊ2��3
C. X��Y��ת���ʲ���� D. c1��ȡֵ��ΧΪ0<c1<0.14 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��úȼ���ŷŵ���������SO2��NOx���γ����ꡢ��Ⱦ����������NaClO2��Һ��Ϊ���ռ���ͬʱ���������������������ش��������⣺
��1�� NaClO2�Ļ�ѧ����Ϊ_______��
��2���ڹ��ݷ�Ӧ����ͨ�뺬�к���SO2��NOx����������Ӧ�¶�Ϊ323 K��NaClO2��ҺŨ��Ϊ5��103mol��L1����Ӧһ��ʱ�����Һ������Ũ�ȵķ���������±���
���� | SO42 | SO32 | NO3 | NO2 | Cl |
c/��mol��L1�� | 8.35��104 | 6.87��106 | 1.5��104 | 1.2��105 | 3.4��103 |
��д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ__________������ѹǿ��NO��ת����______���������������������������������
���������շ�Ӧ�Ľ��У����ռ���Һ��pH��______ ���������������������������������
����ʵ������֪������Ӧ����______������Ӧ���ʣ���������������С��������ԭ���dz���SO2��NO�������еij�ʼŨ�Ȳ�ͬ����������___________��
��3���ڲ�ͬ�¶��£�NaClO2��Һ���������ķ�Ӧ�У�SO2��NO��ƽ���ѹpx��ͼ��ʾ��
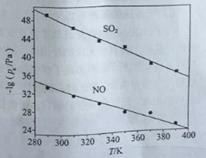
����ͼ������֪����Ӧ�¶����ߣ�����������Ӧ��ƽ�ⳣ����______________��������������������������С������
����ӦClO2+2SO32===2SO42+Cl��ƽ�ⳣ��K����ʽΪ___________��
��4���������NaClO��Ca��ClO��2���NaClO2��Ҳ�ܵõ��Ϻõ���������Ч����
���ӻ�ѧƽ��ԭ��������Ca��ClO��2���NaClO���е��е���_______��
����֪���з�Ӧ��
SO2��g��+2OH��aq�� ===SO32��aq��+H2O��l�� ��H1
ClO��aq��+SO32��aq�� ===SO42��aq��+Cl��aq�� ��H2
CaSO4��s�� ===Ca2+��aq��+SO42��aq�� ��H3
��ӦSO2��g��+ Ca2+��aq��+ ClO��aq�� +2OH��aq�� ="==" CaSO4��s�� +H2O��l�� +Cl��aq������H=______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߾���G��I����������ȫ���オ�����ϣ�������ɫ��Ⱦ���������صĽ���������Ҫ�����á��й�ת����ϵ���£�

��֪����![]()
��H�ķ�������һ������O�����ṹ����Ԫ��
�ۺ��нṹ���л�����Ӳ����ȶ���������ʧˮ�γ�![]() ��
��![]()
��ش���������:
��1��д�����Ľṹ��ʽ___________
��2��д��Hת��ΪI�Ļ�ѧ����ʽ___________
��3��ij������M����ʽΪC4H8O3��д��������������M��ͬ���칹��Ľṹ��ʽ____________
���뻯����F������ͬ�Ĺ����� �ڹ����Ų�����ͬһ��̼��
��4�����������ϳ�·�ߣ�����Լױ�![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·�ߣ���ԭ������ѡ�ϳ�·��������ͼ��ʾ��_______________�ϳ�·������ͼʾ��:
�ĺϳ�·�ߣ���ԭ������ѡ�ϳ�·��������ͼ��ʾ��_______________�ϳ�·������ͼʾ��:
![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ2����ֽƬ���䵽ͼ1�У��ɵõ�һ��������������ԭ��Ӧ�����ӷ���ʽ��δ��ƽ�������жԸ÷�Ӧ��˵������ȷ����

A. IO4����������
B. ����1 mol Mn2+�μӷ�Ӧת��5mol����
C. ��ԭ���������������ʵ���֮��Ϊ2��5
D. ��ƽ��H+��Mn2+�Ļ�ѧ�������ֱ�Ϊ4��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L�ܱ������У�800��ʱ��Ӧ2NO(g)��O2(g) ![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)д���÷�Ӧ��ƽ�ⳣ������ʽ��K��________����֪��K(300��)>K(350��)���÷�Ӧ��________��Ӧ(����ȡ������ȡ�)��
(2)��ͼ�б�ʾNO2�ı仯��������___����O2��Ũ�ȱ仯��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��__________��
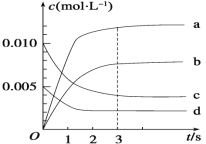
(3)��˵���÷�Ӧ�Ѿ��ﵽƽ��״̬������____��
a��v(NO2)��2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2) d�����������ʵ��ܶȱ��ֲ���
(4)��ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�������____��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч�Ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ���ܡ�̫���ܵ�����һ����Դ
B. X![]() Y��Z����Ӧ���������淴Ӧ��Ȼ����
Y��Z����Ӧ���������淴Ӧ��Ȼ����
C. ��ѧ��Ӧ���ʱ���HԽ������ʾ����Խ��
D. ϡ��Һ��������кͷ�Ӧ����1 mol H2Oʱ���Ȳ�һ��Ϊ57.3 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֱ�SO32����Fe2����Br����I����0.1mol����Һ�У�ͨ���״���µ�Cl2��ͨ��Cl2���������Һ��������ӵ����ʵ�����ϵͼ��ȷ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com