
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);D原子的基态电子排布式为____________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
 (3)1 mol AB-中含有的π键个数为________。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则 LaNin中n=________(填数值);氢在合金中的密度为________。
LaNin中n=________(填数值);氢在合金中的密度为________。
解析:根据题中已知信息,第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级可知,A为碳元素,B为氮元素,C为氧元素,D为铜元素。晶胞的原子个数计算主要注意D原子个数计算,在晶胞上、下两个面上共有4个D原子,在前、后、左、右四个面上共有4个D原子,在晶胞的中心还有一个D原子。镧镍合金储氢后,1 mol晶体中氢元素的质量为4.5 g,则氢在合金中的密度为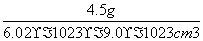 =0.083 g·cm-3。
=0.083 g·cm-3。
答案:(1)C<O<N 1s22s22p63s23p63d104s1或[Ar]3d104s1
(2)sp2 平面三角形 (3)2NA或2×6.02×1023
(4)1∶5 (5)5 0.083 g·cm-3


科目:高中化学 来源: 题型:
在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2 (g)=2HCl(g) ΔH2
2Cl2(g)+2 H2O (g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是 ( )
A.ΔH3=ΔH1+2ΔH2 B.Δ H3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.Δ H3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
化学无处不在,下列与化学有关的说法不正确的是
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.硅胶可以除去氯气中的水蒸气
C.明矾净水属于物理变化
D.黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2 有很强的氧化性,因此常被作为消毒剂,其消毒效率(以单位质量得到的电子数表示)是氯气的( )倍
A. 2.0 B. 2.4 C. 2.5 D. 2.6
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列是A、B、C、D、E五种短周期元素的某些性质。
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
①E原子的核外电子排布式为________;
②上表中的元素可以组成分子式为ADC2的物质,该物质中所有原子最外层均满足8电子稳定结构。则该分子的结构简式为________;中心原子的杂化方式为________;
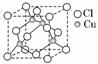
(2)铜的某种氯化物晶体的晶胞结构如图所示,该氯化物的化学式为________;
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
_______________________________________________________________________ _。
_。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于油脂的说法中,不正确的是
( )
A.所有的油脂都能发生皂化反应
B.为了便于油脂的运输,工业上常常把液态油进行氢化
C.油脂都比水轻,浮在水面上
D.纯净的花生油不饱和度高,具有固定的熔、沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
要证明硬脂酸具有酸性,可采用的正确实验是
( )
A.把硬脂酸溶于汽油,向溶液中加入石蕊试液,溶液变红
B.把纯碱加入硬脂酸并微热,产生泡沫
C.把硬脂酸加热熔化,加入金属钠,产生气泡
D.把滴有酚酞试剂的稀烧碱溶液加入硬脂酸中,微热,红色变浅甚至消失
查看答案和解析>>
科目:高中化学 来源: 题型:
浓盐酸和Ca(ClO)2能发生反应:Ca(ClO)2+4HCl(浓)====CaCl2+2H2O+2Cl2↑,用久置漂白粉和浓盐酸反应得到的氯气中,可能含有的杂质气体是①CO2,②HCl,
③H2O,④O2( )
A.①②③ B.②③④
C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是 ( )
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.Z的氢化物的水溶液在空气中存放不易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com