
科目:高中化学 来源: 题型:
| 2 |
| 3 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
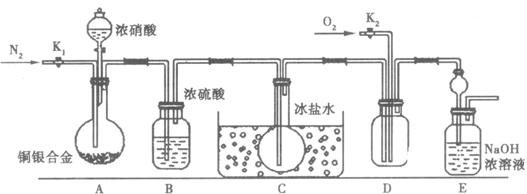
(1)实验开始前先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,其目的是________________________;
(2)装置中B瓶的作用是________________;
(3)A中的反应停止后,打开D中的活塞K2并通入氧气,若反应确有NO产生,则D中应出现的现象是________;实验发现,通入的氧气温度高低对实验现象有较大影响,为便于观察应通入________(填“冷”或“热”)的氧气。
(4)为减小测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是________________________________________________________________。
(5)实验测得下列数据:所用铜银合金质量:15.0 g,浓硝酸:40 mL 13.5 mol/L;实验后A溶液体积:40 mL,H+浓度:1.0 mol/L。假设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为________;②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中铜的质量分数还需测定的数据是________________________________。
(6)已知一定质量的铜银合金粉末,其他试剂和仪器任选,若只要求测定Cu的质量分数,请设计一个简单的实验(只要求写出反映实验原理的化学反应方程式和需要测定的实验数据):________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省魏县一中高一下学期期中考试化学试卷(带解析) 题型:实验题
(14分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。为完成测定并验证有NO生成,有人设计下图实验装置。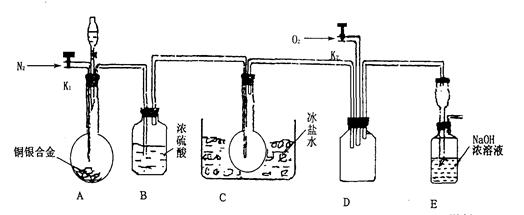
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是________________________________________________。
(2)装置B瓶的作用是___________________________________________。
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是________________;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人_______________(填“冷”或“热”)的氧气。
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是: ___________________________________________________。
(5)实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol·L-1。实验后:A中溶液体积为40mL,H+浓度为1.0mol·L-1。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是__________。
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程_______________ ____。
查看答案和解析>>
科目:高中化学 来源:2013届江西省高二上学期期中考试化学试卷(解析版) 题型:填空题
(17分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
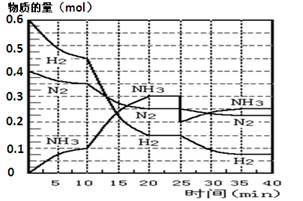
回答下列问题:
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为: ,第2次平衡的时间范围为: ,
第1次平衡:平衡常数K1 = (带数据的表达式),第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:
① 曲线发生变化的原因:
② 达第二次平衡时,新平衡的平衡常数K2 K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) +
3H2O(1)  2NH3(g) +
2NH3(g) +  O2(g)
;△H = a kJ·mol—1
O2(g)
;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g) +
3H2(g) 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com