
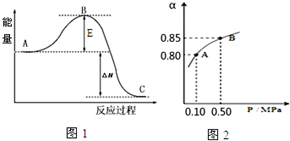
 ��ij10L�ĺ����ܱ������г���2molSO2��1molO2��2SO2��g��+O2��g��?2SO3��g����Ӧ���̵������仯��ͼ1��ʾ����֪1mol SO2��g������Ϊ1mol SO3����99kJ����ش�
��ij10L�ĺ����ܱ������г���2molSO2��1molO2��2SO2��g��+O2��g��?2SO3��g����Ӧ���̵������仯��ͼ1��ʾ����֪1mol SO2��g������Ϊ1mol SO3����99kJ����ش����� ��1��A��C�ֱ��ʾӦ������������������������
��2����������ı��˷�Ӧ��;�������ͷ�Ӧ����Ļ�ܣ�����E�ı仯�Ǽ�С������Ӧ�������������������䣬���Է�Ӧ�Ȳ��䣻
��3�����ݻ�ѧƽ��״̬��������𣬵���Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯������ʱҪע�⣬ѡ���жϵ������������ŷ�Ӧ�Ľ��з����仯�������������ɱ仯����ֵʱ��˵�����淴Ӧ����ƽ��״̬��
��4����ͼ��֪����ϵ��ѹǿΪ0.10MPaʱSO2��ƽ��ת����Ϊ0.8����
2SO2��g��+O2��g�� $?_{��}^{����}$ 2SO3��g��
��ʼ��2.0mol 1.0mol 0
ת����1.6mol 0.8mol 1.6mol
ƽ�⣺0.4mol 0.2mol 1.6mol
��ƽ��ʱ��c��SO2��=0.04mol/L��c��O2��=0.02mol/L��c��SO3��=0.16mol/L������ƽ�ⳣ������ʽ��⣻
��5��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�¶Ȳ��䣮
��� �⣺��1����ͼ��A��C�ֱ��ʾ��Ӧ�������������������������ʴ�Ϊ����Ӧ�����������2molSO2��g����1molO2��g������������
��2����������ı��˷�Ӧ��;�������ͷ�Ӧ����Ļ�ܣ�����E�ı仯�Ǽ�С������Ӧ�������������������䣬���Է�Ӧ�Ȳ��䣬�ʴ�Ϊ�����ͣ����䣻
��3��A����Ӧ����v����SO3��=2v����O2��=2v����O2��������ƽ��״̬����A��ȷ
B�������ڵ������ܶ�һֱ���ֲ��䣬��B����
C�������������ƽ����Է�����������ʱ����仯��˵����������ʵ������䣬��ƽ��״̬����C��ȷ��
D������������ѹǿ���ֲ��䣬˵����������ʵ������䣬��ƽ��״̬����D��ȷ��
��ѡ��ACD��
��4����ͼ��֪����ϵ��ѹǿΪ0.10MPaʱSO2��ƽ��ת����Ϊ0.8����
2SO2��g��+O2��g�� $?_{��}^{����}$ 2SO3��g��
��ʼ��2.0mol 1.0mol 0
ת����1.6mol 0.8mol 1.6mol
ƽ�⣺0.4mol 0.2mol 1.6mol
��ƽ��ʱ��c��SO2��=0.04mol/L��c��O2��=0.02mol/L��c��SO3��=0.16mol/L��
K=$\frac{{c}^{2}��S{O}_{3}��}{{c}^{2}��S{O}_{2}��•c��{O}_{2}��}$=$\frac{0.1{6}^{2}}{0.0{4}^{2}��0.02}$=800��
�ʴ�Ϊ��800��
��5��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�¶Ȳ��䣬��ѹǿ���䣬ƽ��״̬��A�䵽Bʱ����k��A��=k��B����
�ʴ�Ϊ��=��
���� �����ۺϿ��黯ѧƽ��״̬����ѧƽ�ⳣ����ע������Է�Ӧ��Ӱ�죬��Ŀ�Ѷ��еȣ������״���Ϊ��ѧƽ�ⳣ���ļ��㣬ע�������̵İ��գ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
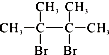 ��F1��F2��Ϊͬ���칹�壬�ӳ�HBrʱF1�����ּӳɲ��F2ֻ��һ�ּӳɲ��G1��G2�ֱ�Ϊͬ���칹�壮�ݴ�����
��F1��F2��Ϊͬ���칹�壬�ӳ�HBrʱF1�����ּӳɲ��F2ֻ��һ�ּӳɲ��G1��G2�ֱ�Ϊͬ���칹�壮�ݴ�����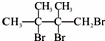 ��
��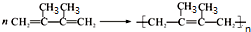
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1����3����4����5����7����12����13�� | B�� | ��2����4����5����7����12����13����14�� | ||
| C�� | ��2����5����7����13����14�� | D�� | ����ѡ�������ȷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
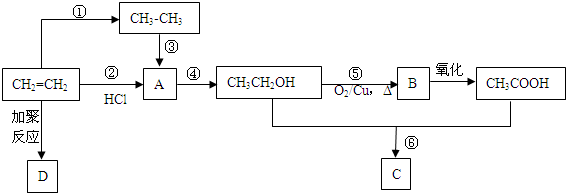
 ��
�� CH3COOC2H5+H2O��
CH3COOC2H5+H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�2.24LC6H14�к���1.9NA�����õ��Ӷ� | |
| B�� | 7.8gNa2O2�����к���������ĿΪ0.1NA | |
| C�� | ��36.5gHCl��Ũ�����������Ķ����������ã��ܲ���0.25NA���������� | |
| D�� | 5.6gFe��������������Ӧת�Ƶĵ�����ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 571.6 kJ•mol-1 | B�� | 482.6 kJ•mol-1 | C�� | 285.8 kJ•mol-1 | D�� | 241.3 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢ� | B�� | �ڢۢ� | C�� | �٢ڢ� | D�� | �ڢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �٢� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com