
分析 (1)根据有机物中含有的官能团进行解答;
(2)根据有机物的结构及性质进行解答;
(3)苯密度小于水,溴单质易溶于有机溶剂苯,所以橙红色位于上层;
(4)苯分子中的碳碳键为独特键,不存在碳碳双键,不能使酸性高锰酸钾溶液褪色.
解答 解:(1)①含有醇羟基的物质为乙醇,结构简式为CH3CH2OH,
故答案为:乙醇;CH3CH2OH;
②-COOH为羧基,含有羧基的为乙酸,
故答案为:乙酸;
(2)①既能发生加成反应,又能发生聚合反应的是,说明含有碳碳双键,满足的物质为乙烯,结构简式为CH2=CH2,
故答案为:乙烯;CH2=CH2;
②五种物质中能够发生水解反应的只有乙酸乙酯,
故答案为:乙酸乙酯;
(3)苯的密度比水的密度小,有机层在混合液的上层,所以橙红色位于上层,
故答案为:上;
(4)苯中的碳碳键为介于单键和双键之间的独特键,不存在碳碳双键,不能使酸性高锰酸钾溶液褪色,
故答案为:没有.
点评 本题考查有机物的结构和性质,侧重于有机物知识的综合应用,为高考常见题型,难度不大,注意把握有机物的结构特点和官能团的性质,为解答该题的关键.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池在放电过程中,电池反应液的pH将变小 | |
| B. | 相同条件下,结合质子的能力:OH->ClO->CH3COO- | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率,平衡常数保持不变 | |
| D. | 在氯化银悬浊液中加入NaBr溶液,沉淀由白色转变为淡黄色,说明Ksp(AgCl)>Ksp(AgBr) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
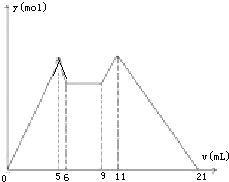 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )| A. | A是盐酸,B是NaOH,且C(NaOH)=2C(HCl) | |
| B. | 原混合液中,C(Al3+):C(Mg2+):C(Cl-)=1:1:5 | |
| C. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳元素能够形成不同的单质,如C60、C70、金刚石等等.
碳元素能够形成不同的单质,如C60、C70、金刚石等等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔分子比例模型: | B. | 乙烯分子的结构简式为CH2CH2 | ||
| C. | 一氯甲烷的电子式为: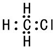 | D. | 2-甲基丁烷的键线式: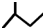 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子结构决定了元素在周期表中的位置 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在过渡元素中寻找半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com