
| A. | PCl3、NH3 | B. | BF3、H2O | C. | CCl4、H2S | D. | BeCl2、BF3 |
分析 物质中,中心原子的杂化类型为sp3不等性杂化,说明中心原子价层电子对个数是4并且含有孤对电子,根据价层电子对个数确定中心原子杂化类型.
解答 解:A.PCl3分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3)=4,NH3分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3)=4,所以均采用sp3不等性杂化,故A正确;
B.BF3分子中B原子含有3个σ键且不含孤电子对,所以B原子价层电子对个数是3,则B原子采用sp2杂化;H2O分子中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(6-2)=4,所以H2O采用sp3不等性杂化,故B错误;
C.CCl4分子中C原子含有4个σ键且不含孤电子对,所以C原子价层电子对个数是4,则C原子采用sp3等性杂化;H2S分子中价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(6-2)=4,所以H2S采用sp3不等性杂化,故C错误;
D.BF3分子中B原子含有3个σ键且不含孤电子对,所以B原子价层电子对个数是3,则B原子采用sp2杂化;BeCl2分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心原子以sp杂化轨道成键,故D错误;
故选A.
点评 本题考查了中心原子杂化方式判断,为高考热点,根据价层电子对互斥理论分析即可,知道价层电子对个数的计算方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 第IA族碱金属元素最高价氧化物的水化物的碱性随原子序数递增而增强 | |
| B. | 第ⅦA族元素是同周期中非金属性最强的元素 | |
| C. | 第ⅦA元素从上到下,其氢化物的稳定性逐渐减弱 | |
| D. | 同周期元素(除0族元素外)从左到右,原子半径和离子半径都逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | V(H2O)=0.003mol/(L•S) | B. | V(NH3)=0.003mol/(L•S) | ||
| C. | V(NH3)=0.002mol/(L•S) | D. | V(O2)=0.005mol/(L•S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
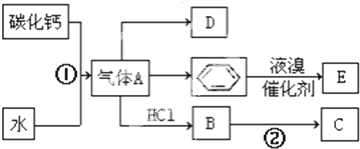
 ;D的结构简式CH2=CH2;
;D的结构简式CH2=CH2;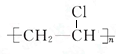 ;反应类型加聚反应;
;反应类型加聚反应; +Br2 $\stackrel{催化剂}{→}$
+Br2 $\stackrel{催化剂}{→}$ +HBr;反应类型取代反应.
+HBr;反应类型取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 3:2 | C. | 1:2 | D. | 6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(NO2)COOH分子中含有“手性碳原子” | |
| B. | HS-和HC1均是含一个极性键的18电子粒子 | |
| C. | 当用带有静电的玻璃棒接近CH2Cl2和CC14液体细流时,细流都不发生偏转 | |
| D. | 1mol己烷含有的共价键数目为19NA(NA代表阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg>Al | B. | 原子半径:Cl>Si>O | ||
| C. | 熔点:SiO2>NaCl>SO2 | D. | 酸性:HClO4>H2SO4>H2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com