
| A. | 五氯化磷 | B. | 光气(化学式为:COCl2) | ||
| C. | 二硫化碳 | D. | 三氯化硼 |
分析 分子中某原子最外层电子数=元素原子最外层电子数+该元素原子化合价绝对值,若该值等于8,则该原子满足8电子结构,据此分析解答.
解答 解:A.PCl5中Cl元素化合价为-1,Cl原子最外层电子数是7,1+7=8,P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,分子中P原子不满足8电子结构,故A选;
B.COCl2中C元素化合价为+4,C原子最外层电子数是4,4+4=8,O元素化合价为-2,原子最外层电子数为6,所以6+2=8,Cl原子最外层电子数是7,1+7=8,则都满足最外层8电子稳定结构,故B不选;
C.CS2为共价化合物,CS2分子中C元素化合价为+4,C原子最外层电子数是4,4+4=8,所以碳原子满足8电子结构,S元素化合价为-2,S原子最外层电子数是6,6+2=8,C、S原子均满足8个电子稳定结构,故C不选;
D.BCl3中Cl元素化合价为-1,Cl原子最外层电子数是7,1+7=8,B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,分子中B原子不满足8电子结构,故D选;
故选AD.
点评 本题考查共价键,注意对8电子结构判断,分子中含有氢元素,该分子一定不满足各原子达8电子结构,题目难度不大.


科目:高中化学 来源: 题型:解答题
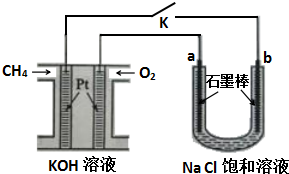
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
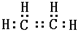 B的结构简式CH3CH2OH
B的结构简式CH3CH2OH查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
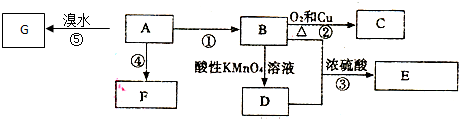
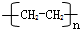 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) | ||
| C. | c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | D. | c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com