
【题目】下列说法正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-801.3kJ/mol 结论:CH4的燃烧热为801.3kJ/mol
B. Sn(s,灰) ![]() Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
C. 稀溶液中有:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol结论:将盐酸与氨水的稀溶液混合后,若生成1mol H2O,则会放出57.3kJ的能量
D. C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1 结论:相同条件下金刚石性质比石墨稳定
【答案】B
【解析】
A.在25℃、101 kPa时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,产物水的状态不是液态,A错误;
B.由于该反应正反应为吸热反应,温度越低越有利于反应逆向进行,所以锡制品在寒冷的冬天因易转化为灰锡而损坏,B正确;
C.该热化学方程式表示“在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时放出57.3kJ的热量”,氨水为弱碱溶液,电离需要吸热,所以将盐酸与氨水的稀溶液混合后,若生成1mol H2O,则放出能量小于57.3kJ,C错误;
D.根据盖斯定律:
C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1 ①
C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1 ②
①-②得C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1,根据能量越低越稳定原理,石墨比金刚石稳定,D错误;
正确答案:B。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]________,下列状态的铝中,电离最外层的一个电子所需能量最小的是_____________(填标号)。
A. ![]() B.
B. ![]() C.[Ne] D.
C.[Ne] D. ![]()
(2)8—羟基喹啉铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与 (8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______;
(8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______; 所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为 _____、_________和____________。
所含元素中电负性最大的是___(填元素符号),C、N、O的杂化方式依次为 _____、_________和____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表中卤化物的熔点产生差异的原因是____________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为_______;其中Al的配位数为_________。
(4)GaAs的晶胞结构如图所示,紧邻的As原子之间的距离为x,紧邻的As、Ga原子之间的距离为y,则![]() =________。
=________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是()
3C+4D反应中,表示该反应速率最快的是()
A.v(A)=0.5 mol/(L·min) B.v(B)=0.3 mol/(L·min)
C.v(C)=0.8 mol/(L·min) D.v(D)=1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu(OH)2在水溶液中存在着如下沉淀溶解平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。在常温下如果要生成Cu(OH)2沉淀,需要向0.02mol/L的CuSO4溶液中加入碱来调整溶液的pH,应使溶液的pH大于( )
A.3B.4C.5D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是:

A. 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图3表示H2与O2发生反应过程中的能量变化,则氢气的燃烧热为241.8kJ·mo1ˉ1
D. 图4表示用水稀释等体积且pH相同的盐酸和醋酸,溶液导电性:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为5 L的真空密闭容器中加入1.25 mol CaCO3,发生反应CaCO3 (s)![]() CaO(s) +CO2(g),测得平衡时二氧化碳的物质的量浓度随温度的变化关系如图所示:
CaO(s) +CO2(g),测得平衡时二氧化碳的物质的量浓度随温度的变化关系如图所示:
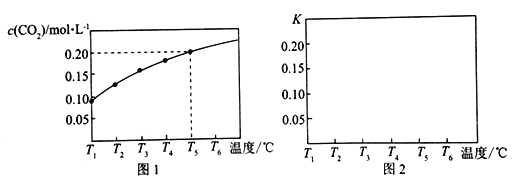
请按要求回答下列问题:
(1)该反应正反应为__________热反应(填“吸”或“放”),温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平均反应速率为________________。
(2)T2℃时,该反应已经达到平衡,下列措施中能使该反应的平衡常数K值变大的是_______________(选填编号)。
a.减小压强 b.减少CaO的量 c.加入CaCO3 d.升高温度
(3)请在如图中画出平衡常数K随温度的变化曲线_______________。
(4)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入1molN2,则最后平衡时容器中的CaCO3的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
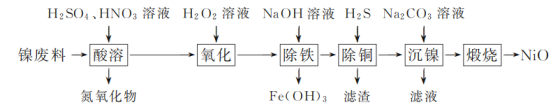
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“除铁”时需控制溶液的pH范围为________。
(2)“滤渣”的主要成分为________(填化学式)。
(3)“沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:CH3OCH3的选择性=![]() ×100%
×100%
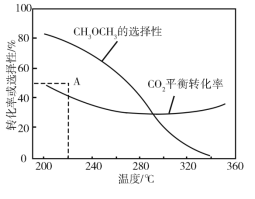
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子式为 C4H8,据此推侧其结构和性质不可能的是
A. 它与乙烯可能是同系物
B. 一氯代物只有一种
C. 分子结构中甲基的数目可能是 0、1、2
D. 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com